
科目: 来源: 题型:
【题目】配平化学反应方程式并标出电子转移的方向和总数:
____Fe(NO3)3 + ____NaOH + ___Cl2 → ___Na2FeO4 + ____NaNO3 + ___NaCl + ____H2O,___________
(1)上述反应中______元素被氧化,发生还原反应的物质是_________
(2)写出铁元素在元素周期表中的位置是第______周期第____________族
(3)写出上述反应中还原产物的电子式___________________
(4)若反应中转移了0.1 mol电子,则消耗了_______L Cl2(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
铂(Pt)及其化合物的用途广泛。
(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于_______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的外围电子排布式为_______。
![]()
②吡啶分子是大体积平面配体,其结构简式如右图所示,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是____、____,各元素的电负性由大到小的顺序为_______。
③二氯二吡啶合铂分子中存在的微粒间作用力有______(填序号)。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。
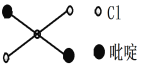
简述理由:_____________________________。
⑤反式二氯二吡啶合铂分子结构如右图所示,该分子
是_______分子(选填“极性”、“非极性”)。
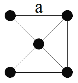
(3)金属铂晶体中,铂原子的配位数为12,其面心立方晶胞沿 x、y或z轴的投影图如右图所示。若金属铂的密度为d g·cm-3,则晶胞参数a=____________nm(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:
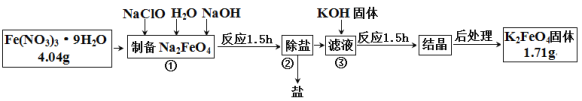
回答下列问题:
(1)步骤①中NaClO作______(填“氧化剂”“还原剂”或“催化剂”)。
(2)步骤②脱除的盐除NaNO3 外,还有 ____________(填化学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4 _____(填“>”或“<”)K2FeO4。
(4)本次实验中K2FeO4的产率为__________________。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸入一根带火星的木条,木条复燃;再向溶液中加入KSCN溶液,溶液变为血红色。如果标况下产生气体2.24L,则参加反应的FeO42- 数目_____________;K2FeO4作为净水剂的优点除铁无毒,能消毒杀菌外还有__________________________________。
(6)某同学设计以下两个实验探究高铁酸钾的稳定性。
(实验1)将适量K2FeO4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0mmolL-1(1mmolL-1=10-3molL-1)的试样,静置,结果见图1。
(实验2)将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为1.0mmolL-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,结果见图2。
(实验结论)根据图一,可以得出的结论是:________________________________________
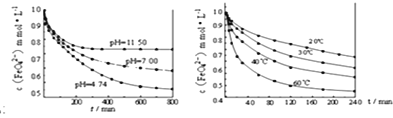
图1 图2
(7)常温下,某水溶液含有Fe3+,Cu2+,调节溶液pH=10时,两种氢氧化物沉淀共存,已知该温度下, Ksp(Fe(OH)3)= a, Ksp(Cu(OH)2)= b,则溶液中C(Fe3+)/C(Cu2+)=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】LED(Light EmittingDiode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是:
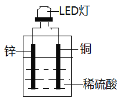
A. 装置中存在“化学能→电能→光能”的转化
B. 铜片上发生的反应为2H++2e-=H2↑
C. 如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
D. 如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目: 来源: 题型:
【题目】总的物质的量为0.50mol的Fe粉与Al粉混合物分为等质量的两份;在一份中加入足量的稀盐酸,在标准状况下产生气体aL;在另一份中加入足量的氢氧化钠溶液,在标准状况下产生气体bL。则a+b的数值不可能是( )
A. 5.6 B. 7.3 C. 8.2 D. 11.2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知液氨能和NaH反应放出H2:NaH + NH3 =NaNH2 + H2↑,它也能和Na反应放出H2。据此下列说法中错误的是( )
A. 液氨和NaH反应中,液氨是氧化剂
B. 液氨和NaH反应生成的H2既是氧化产物又是还原产物
C. 液氨和Na反应产物中有NaNH2
D. 液氨和NaH或Na反应都属于置换反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中正确的是( )
A. 常温下,1 L 0.1 mol·L-1 MgCl2溶液中含Mg2+数为0.1NA
B. 常温常压下的33.6 L Cl2与27g Al充分反应,转移电子数为3 NA
C. 1mol单质铁被氧化时一定失去3NA个电子
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容容器中:2NO2 ![]() 2NO+O2。不能说明反应达平衡状态的是:
2NO+O2。不能说明反应达平衡状态的是:
①单位时间内生成n mol O2的同时生成2n mol NO2; ②单位时间内生成n mol O2 的同时,生成2n mol NO; ③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态; ④混合气体的颜色不再改变的状态; ⑤混合气体的密度不再改变的状态; ⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com