
科目: 来源: 题型:
【题目】2011年3月11日在日本发生的大地震中,福岛核电站发生了核泄漏,其周边区域的空气中漂浮着放射性物质,其中含有碘的同位素13153I,13153I中的质子数为
A. 53 B. 78 C. 131 D. 184
查看答案和解析>>
科目: 来源: 题型:
【题目】液氨—液氧燃料电池曾用于驱动潜艇,其示意图如图所示。
(1)该电池的总反应式为_____________,电极1发生的电极反应为__________;
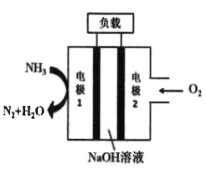
(2)下列说法正确的是______________;
A. 电极2是正极,发生还原反应
B. 电池工作时,Na+向电极1移动
C. 电流由电极2经外电路流向电极1
D. 该装置将化学能转化为电能再转化为机械能
(3)当电路中通过的电子数为0.4mol时,理论上需消耗标准状况下氧气的体积为________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是( )
A. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致
B. 乳酸(![]() )有一对手性异构体,因为其分子中含有一个手性碳原子
)有一对手性异构体,因为其分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
D. 酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知下列各种共价键的键能:C—H:a kJ· mol-1、O—H:b kJ· mol-1、O=O:c kJ·mol-1、C=O:d kJ·mol-1。写出甲烷气体完全燃烧生成CO2气体和气体水的热化学方程式:_________________________________
(2)火箭中的主要燃料是“肼(也称为联氨)”的液体物质。此化合物的相对分子质量为32。其中,含N的质量分数为87.5%,其余为H元素。则:
①肼的化学式为__________________,其结构式为_____________________________
②此燃料的氧化剂是N2O4气体,若燃烧0.2 mol肼液体放出的热量为 400 kJ,燃烧的产物对大气都无污染(生成的水为液态),则肼与N2O4气体反应的热化学方程式为:__________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)(题文)化合物G是一种医药中同体,常用于制备抗凝血药。可以通过下图所示的路线合成
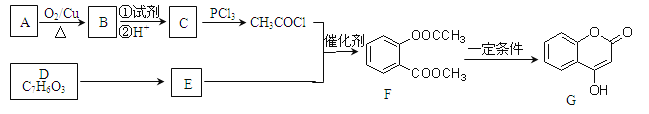
已知: RCOOH![]() RCOCl; D与FeCl3溶液能发生显色。
RCOCl; D与FeCl3溶液能发生显色。
(1)A→B的反应类型是_______________,B→C 的转化所加的试剂①可能是____________。
(2)E的结构简式为_______________________。
(3)F与足量NaOH溶液充分反应的化学方程式为_____________________________________。
(4)同时满足下列条件的所有E的同分导构体的结构简式共有__________种。
①能发生水解反应②与FeCl3溶液能发生显色反应 ③苯环上有两种不同化学环境的氢原子
(5)己知:酚羟基一般不易直接与羧酸酯化。 而苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。试写出以苯酚,甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_____________________________________________。
)是一种重要的有机合成中间体。试写出以苯酚,甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_____________________________________________。
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ:为使空气质量达标,完成二氧化硫,氮氧化物排放量下降的目标,离不开各种化学处理方法。一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO3(g)△H=-296kJ·mol-1
SO3(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是___________________。
Ⅱ:如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
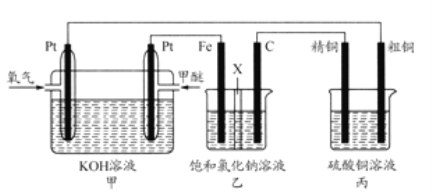
(1)甲醚燃料电池的负极反应式____________。
(2)石墨电极(C)的电极反应式为____________________________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____________(填“增大”“减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为____________;则乙装置中生成标况下气体的体积为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在 T ℃时,将ag NH3完全溶于水,得到V mL 溶液,假设该溶液的密度为d g/mL,溶质的质量分数为w,其中含 NH4 +的物质的量为b mol。下列叙述中正确的是
A. 溶质的质量分数为 w=1000a/17V×100%
B. 溶质的物质的量浓度 c=1000a/17V mol·L-1
C. 溶液中 c(OH-)=1000b/17V mol·L-1
D. 上述溶液中再加入V mL 水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是

A. 该硫酸的物质的量浓度为 9.2 mol/L
B. 1 mol Zn与足量的该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在周期表中位置如图所示,请回答下列问题:
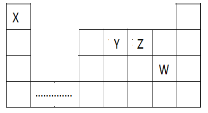
(1)四种元素的原子半径由小到大的顺序为(用字母表示):__________________________________________
(2)写出由X、Y、Z三种元素形成的满足下列条件的化合物的化学式各一种:离子化合物_________________,共价化合物_________________
(3)X与其余三种元素之间形成的核外电子总数为10的微粒有________种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com