
科目: 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 焊接铁轨:2Fe+Al2O3![]() 2Al+Fe2O3
2Al+Fe2O3
B. 人工固氮:N2+3H2![]() 2NH3
2NH3
C. 用纯碱除油污:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
D. 用湿润的淀粉KI试纸检验Cl2:Cl2+2I-=2Cl-+I2
查看答案和解析>>
科目: 来源: 题型:
【题目】I.某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:

(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:烧杯、托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是______________。
(2)写出步骤①中发生反应的离子方程式___________
(3)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?________。若合理,请用离子方程式解释其原因_________________________________(若你认为不合理,该空不作答)。

II.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:_____________________________
(2)实验②的化学反应中转移电子的物质的量是_______________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】原子结构与元素周期表、元素性质三者关系密切。
A、B、D、E、F为原子序数依次增大的前四周期元素,其中A的最外层电子数是其内层电子数的2倍,B、D、E为同周期元素,B原子的核外电子总数是其未成对电子数的5倍,E原子最外层有1个未成对电子,F原子核外有22种运动状态的电子。
请回答下列问题:
(1)F元素位于周期表_____________区,其价电子排布图为:_____________。
(2)B、D、E三种元素中,第一电离能最小的是_____________ (填元素符号);写出AD2的等电子体_____________ (分子和阴离子各写一种)。
(3)AO2和DO2熔点高的是_____________,原因是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验中需用0.2 mol/L的Na2CO3溶液450 mL,配制时应称取Na2CO3固体的质量为_______
(2)下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:
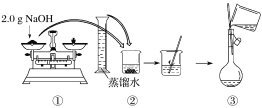

该同学的错误步骤有____________处
(3)配制220 mL 1.0 mol·L-1硫酸溶液:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用_______mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______________________
(4)在配制4.6 mol/L稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)?
①容量瓶检漏后未干燥就使用:____________。
②定容时仰视观察液面:_____。
③移液后未洗涤烧杯和玻璃棒:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
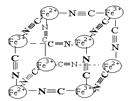
A. 该晶体是原子晶体
B. M的离子位于上述立方体的面心,呈+2价
C. M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50%
D. 晶体的化学式可表示为MFe2(CN)3,且M为+1价
查看答案和解析>>
科目: 来源: 题型:
【题目】某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO和H2O。已知水是反应产物之一,写出该反应的化学方程式,并用单线桥法标出电子转移的方向和数目:_________________________。若反应过程中转移了1.2mol电子,则生成水的质量是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在80 ℃时,将0.20 mol的N2O4气体充入1 L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间 /(s) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) / mol · L-1 | 0.20 | c1 | 0.10 | c2 | c3 | c4 |
c(NO2) / mol · L-1 | 0.00 | 0.12 | 0.20 | 0.22 | 0.22 | 0.22 |
根据本题内容和表中提供数据填空(c1、c2、c3、c4表示相应的浓度),请回答下列各小题:
(1)该反应化学方程式_________________________; 表中c2____c3(填“<”、“>”或“=”)
(2)c4=_______mol · L-1,在0~20 s内NO2的平均反应速率为______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料,右图为其晶胞,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )

A. 磷化硼晶体的熔点很低
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体中每个原子均形成4条共价键
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com