
科目: 来源: 题型:
【题目】下列实验操作或事实与预期实验目的或所得结论对应正确的是( )
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含所有FeCl3 |
B | CaO | 用生石灰制备NaOH溶液 |
C | 新收集的酸雨 | 酸雨中一定含有SO42- |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于三元酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:akJmol-1、P-O:bkJmol-1、P=O:ckJmol-1、O=O:dkJmol-1.根据图示的分子结构和有关数据估算1mol白磷反应放出的热量,其中正确的是
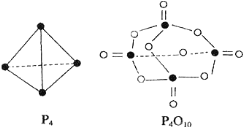
A. (6a+5d-4c-12b)kjB. (4c+12b-6a-5d)kJ
C. (4c+12b-4a-5d)kJD. (4a+5d-4c-12b)kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】研究晶体的结构对化学新材料的发现有着重要的价值。
(1)晶胞中任一个原子的中心位置均可用称之为原子分数坐标的三个分别小于1的数(x,y,z)来予以规定。某晶体的晶胞结构如图所示,1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),该晶体的化学式为___________,该晶胞参数为:a = 250.4 pm, c = 666.1 pm,γ = 120o; 3号原子坐标为_____________,列出上述晶体中A和B两原子间的最小核间距的计算式为_____________。(不必算出数值,但需要化简)

(2)体心立方堆积的晶胞是个立方体,如果半径为r的原子保持紧密接触,立方体的中心能容得下半径最大为___________的一个原子。
(3)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28×10-10 m,则FexO中x=__________(结果保留两位有效数字)。
(4)钙钛矿晶体的结构如图所示。假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被__________个氧离子包围;钙离子位于立方晶胞的体心,一个钙离子被_____个氧离子包围。钙钛矿晶体的化学式为__________。若氧离子半径为a pm,则钙钛矿晶体中两个钛离子间最短距离为_______pm,钛离子与钙离子间最短距离为_______pm。

(5)钛元素有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示F晶体的结构中,晶胞参数a=0.295nm,c=0.469nm,则该F晶体的密度为_____________ g· cm-3
(用NA表示阿伏加德罗常数的值,列出计算式即可,不用化简)。

查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
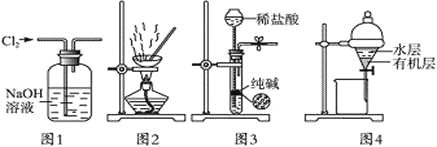
A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目: 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)氯吡苯脲是一种西瓜膨大剂(植物生长调节剂),其组成结构和物理性质见下表。
分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
C12H10ClN3O |
| 白色结晶粉末 | 170~172 ℃ | 易溶于水 |
查文献可知,可用2-氯-4-氨吡啶与异氰酸苯酯反应,生成氯吡苯脲。
![]()
反应过程中,每生成1 mol氯吡苯脲,断裂____个σ键、断裂____个π键。
(2)过渡金属离子与水分子形成的配合物是否有颜色与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如Co(H2O)6]2+显粉红色。据此判断:Mn(H2O)6]2+_____(填“无”或“有”)颜色。
(3)硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成B(OH)4]-而体现一元弱酸的性质,则B(OH)4]-中B的原子杂化类型为_________;
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1 266 | 1 534 | 183 |
解释表中氟化物熔点差异的原因:___________________________________。
(5)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R 代表)。经X-射线衍射测得化合物R 的晶体结构,其局部结构如下图所示。

①组成化合物R 的两种阳离子中σ键的个数之比为____________;其中四核阳离子的立体构型为____________,其中心原子的杂化轨道类型是____________。
②分子中的大π键可用符号表示πmn,其中m 代表参与形成的大π键原子数,n 代表参与形成的大π键电子数,如苯分了中的大π键可表示为π66。则N5-中的大π键应表示为____________。
③请表示出上图中的氢键:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】任何科学真理的发现,都不是一帆风顺的,门捷列夫的元素周期表奠定了现代化学和物理学的理论基础。下列关于元素周期表的说法中,不正确的是
A. 周期表中的副族、Ⅷ族都是金属元素
B. 周期表中的ⅡA族都是金属元素
C. 周期表中的非金属元素都位于短周期
D. 周期表中的0族元素都是非金属元素
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 物质的量是表示物质所含微观粒子多少的一个物理量
B. 物质的量的单位——摩尔,只适用于分子、原子和离子
C. 摩尔只能用来计量纯净物中微观粒子的数目
D. 摩尔不能用来计量混合气体中分子的数目
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表中前四周期的部分元素,表中所列的字母分别代表一种化学元素,根据要求回答下列各小题:
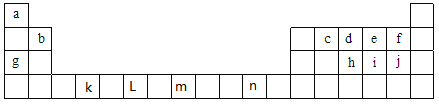
(1)①元素非金属性强弱比较有很多方法,其中f和j的非金属性强弱的研究方案中不可行的是_________(填序号)
a.比较两种单质的颜色 b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较电负性 e.比较最高价氧化物对应水合物的酸性
②根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,则属于s区的元素有_______种,属于d区的元素有_______种;元素n属于________区。
③在c、d、e三种元素中,电负性由小到大的顺序是______________,第一电离能由大到小的顺序是____________(用元素符号回答)。
(2)①写出 n2+的核外电子排布式:______________________。
②写出k元素基态原子的价电子排布式:_____________。
③写出 L元素基态原子的外围电子排布式:_____________。
④写出m元素基态原子价电子的轨道表示式:________________________,该元素在元素周期表中的位置为:__________________________。
⑤j简单阴离子的结构示意图为____________。
(3)①元素i的氢化物分子属于____________(填“极性”或“非极性”)分子,其分子的空间构型为____________,该氢化物分子中i原子轨道的杂化类型是__________; 由i与e形成的ie42-离子,其空间构型为__________(用文字描述)。
②已知cd- 与 d2 结构相似,1 mol cd- 中![]() 键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
③f2通入稀NaOH溶液中可生成Of2,Of2分子构型为___________,其中氧原子的杂化方式为_______;
④化合物j2e的立体构型为_________,中心原子的价层电子对数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A. 蛋白质是由C、H、O、N四种元素组成的物质
B. 硝基乙烷(CH3CH2NO2)与甘氨酸(氨基乙酸)互为同分异构体
C. 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程
D. 合成高聚物![]() 的单体是
的单体是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】将2.80 g含氧化镁的镁条完全溶于50.0 mL硫酸溶液后,滴加2.00 mol·Lˉ1氢氧化钠溶液,恰好完全沉淀时用去200.0 mL。将所得的沉淀灼烧、冷却后称量得固体质量为4.40 g。
(1)求上述硫酸的物质的量浓度c(H2SO4)=____________________________。
(2)镁条中氧化镁和镁的物质的量之比为n(MgO)︰n(Mg)=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com