
科目: 来源: 题型:
【题目】过氧化钠跟足量的 NaHCO3混合后,在密闭容器中充分加热,排净气体物质后冷却残留的固体物质是( )
A. Na2CO3 B. NaOH、Na2CO3
C. Na2O2、Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除去括号内杂质所选试剂正确的是( )
A. Cu(CuO):稀硝酸B. FeCl3(AlCl3):氨水
C. Fe2O3(SiO2):NaOH溶液D. CO2(HCl):饱和Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
![]()
(1)写出元素符号:A_________;B______;C_________。
(2)C的原子结构示意图:__________;B的最高价氧化物对应水化物的化学式为_________。
(3)A的氢化物的水溶液显______(填酸或碱)性。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化钠、氢氧化钙的溶液都具有相似的化学性质,其原因是( )
A.都能电离出金属离子B.都能与酸反应生成盐和水
C.都能使无色酚酞溶液变成红色D.溶液中都含有OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________。
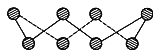
(2)O、S、Se元素的电负性由大到小的顺序为______________________。
(3)H2Se的酸性比H2S_______(填“强”或“弱”),气态SeO3分子的立体构型为__________。
(4)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________________________;
②H2SeO4比H2SeO3酸性强的原因:____________________________________________。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为________________g·cm-3(列式并计算),(1pm=10-10 cm)
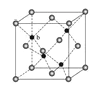
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于金属的说法正确的是( )
A. 所有金属都是银白色的固体
B. 钠和钾的合金常用作原子反应堆的导热剂
C. 工业常用电解熔融态的AlCl3冶炼铝
D. 在船舶外壳上加一块铜,可以减慢铁的腐蚀速率
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_______。
<>(3)最高价氧化物是两性氧化物的元素是___;写出它的氧化物与氢氧化钠反应的离子方程式______。(4)用电子式表示元素④与⑥的化合物的形成过程:__________,该化合物属于_____(填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式______________,该化合物是由_________(填“极性”“非极性”下同)键形成的。
查看答案和解析>>
科目: 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
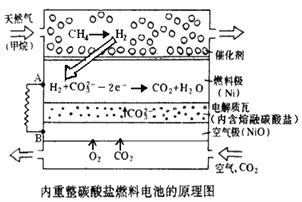
(1)外电路电子流动方向:由_____流向_____(填字母)。
(2)正极发生反应的离子方程式是_______________________________________________.
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e 转移,有_______ g 精铜析出。
(4)25℃时,用石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为____________________; 此时溶液的pH=________(溶液体积变化忽略不计)。
(5)已知常温下Fe(OH)3的溶度积Ksp=1.0×10-38,通常认为残留在溶液中的离子浓度小于 1.0×10-5 mol·L-1时就认为沉淀完全,若使CuCl2溶液中的Fe3+完全沉淀溶液的pH应为_________;加入物质A以调节溶液pH至所需值,A的化学式可以是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工业生产中有广泛用。
(1)稀硝酸与二价活泼金属M反应制备硝酸盐,当反应物之比n(HNO3)∶n(M)=5∶2时,还原产物为___(填化学式)。
(2)连二次硝酸(HO-N=N-OH)是一种二元弱酸,向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色 ,用离子方程式表示其主要原因:__________________。
(3)已知以下热化学方程式: 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH1
4NO2(g)+O2(g) ΔH1
2NO(g)+O2(g)=2NO2(g) ΔH2
3NO2(g)![]() N2O5(g)+NO(g) ΔH3
N2O5(g)+NO(g) ΔH3
①ΔH3=______________________(用ΔH1、ΔH2表示)。
②一定温度下,在恒容密闭容器中进行反应:3NO2(g)![]() N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________。
N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________。
A.容器内总压强保持不变 B.容器内气体密度保持不变
C.v正(NO2)∶v逆(N2O5)=3∶1 D.![]() 保持不变
保持不变
(4)在密闭容器中充入NO,发生反应2NO(g)![]() N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
①ΔH________0。(填“>”“<”或“=”)
②上述反应达到平衡之后,仅缩小容器体积,下列推断正确的是_________。
A.NO的浓度不再变化
B.NO的转化率不再变化
C.正、逆反应速率不再变化
D.容器内气体压强不再变化
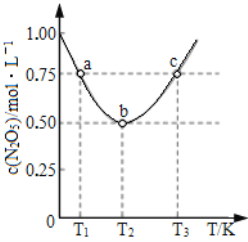
(5)在2 L恒容密闭容器中投入一定量的N2O5(g),发生反应:2N2O5(g)![]() 4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________(填“增大”“减小”或“不变”)。
4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com