
科目: 来源: 题型:
【题目】在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻松振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是()
a(干燥气体) | b(液体) | |
A | NO | 水 |
B | CO2 | 4molL-1NaOH溶液 |
C | Cl2 | 饱和NaCl溶液 |
D | NH3 | 1molL-1盐酸 |
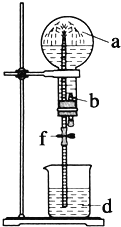
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列计算结果正确是( )
A. 0.5L、8mol/L 浓盐酸与足量MnO2完全反应产生22.4L(标准状况下)Cl2
B. 2H2S+SO2═3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1:2
C. 将NO2和O2等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的![]()
D. 标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为![]() mol/L
mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列常见物质的俗名与化学式相对应的是:
A. 熟石灰--CaO B. 铝热剂--Fe、Al2O3
C. 石膏--CaSO4·2H2O D. 绿矾--CuSO4·5H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1=-159.47kJ/mol K1
NH2COONH4(s) △H1=-159.47kJ/mol K1
反应II:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3 K3
CO(NH2)2(s)+H2O(g) △H3 K3
请回答下列问题:
(1)①总反应的△H3=_______kJ/mol。该热化学方程式的平衡常数K3=____________(用K1、K2表示)。
②反应I一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列不能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2)
D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)。
(2)在体积可变的恒压(p总)密闭容器中充入1 mol CO2 与足量的碳,让其发生反应:C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。

①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“=”);若充入等体积的CO2 和CO,平衡________移动(填“正向”“逆向”或“不”)。
②650℃,CO2 的转化率为_____________。
③已知:气体分压(P分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡常数,925℃时,Kp=_____________ (用含P总的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是( )
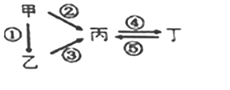
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | S | H2S | SO3 | H2SO4 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂不可能是 ( )
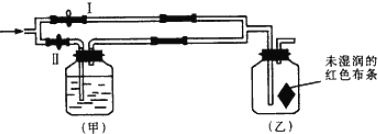
A. 浓H2SO4B. NaCl溶液C. Ba(OH)2溶液D. NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】实验中需2 mol·L-1的碳酸钠溶液950 mL,配制时应选用的容量瓶的规格是
A. 1 000 mL B. 950 mL C. 900 mL D. 500 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】用方铅矿精矿(主要为PbS)和软锰矿(主要为MnO2,还有少量Fe2O3,Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程如下:

已知:①PbS+MnO2+4H+=Mn2++Pb2++S+2H2O
②25℃时,Ksp(PbCl2)=1.6×10-5,Ksp(PbSO4)=1.8×10-8
③PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)△H>0
PbCl42-(aq)△H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是_________________;加入物质X可用于调节酸浸液的pH值,物质X可以是___________(填字母)。
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有两种金属杂质形成的化合物,其成分为_____________(写化学式);
请设计分离两种金属化合物的路线图(用化学式表示物质,用箭头表示转化关系,箭头上注明试剂和分离方法)。______________________________________
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式。___________________________________
(5)用Mn3O4为原料可以获得金属锰,选择合适的冶炼方法为___________(填字母)。
A.热还原法 B.电解法 C.热分解法
(6)求25℃氯化铅沉淀转化为硫酸铅沉淀反应的平衡常数K=___________(保留到整数位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
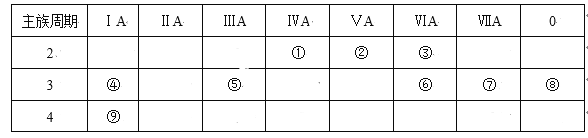
(1)在这些元素中,化学性质最不活泼的是:_____(填具体化学用语,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是:_____。
(3)最高价氧化物是两性氧化物的元素是___;写出它的氧化物与氢氧化钠反应的离子方程式__。
(4)②氢化物与③的单质在一定条件下反应的化学方程式为:______。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________。
(6)用结构式表示元素①与③形成的化合物____,该化合物在固体时俗称___,属于____晶体,指出它的一种用途___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com