
科目: 来源: 题型:
【题目】按题给要求填空
(1)某烷烃1分子含有50个电子,该烷烃只能由一种结构的炔烃加氢得到,则该烷烃的结构简式为_________________或_________________ 。
(2)分子式为C6H12 的某烃的所有碳原子都在同一平面上,则该烃的结构简式为_____________________________,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_____________________________________。
(3)写出以乙炔为原料制备聚氯乙烯反应方程式(无机物不限)
①___________________________________________________。
②___________________________________________________。
(4)下列卤代烃在 KOH 醇溶液中加热不反应的是_____________________(填序号)。
①![]() ②(CH3)2CHCH2Cl ③
②(CH3)2CHCH2Cl ③![]() ④CHCl2CH2Br
④CHCl2CH2Br
⑤(CH3)3CCH2Cl ⑥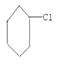 ⑦CH2=CHCl
⑦CH2=CHCl
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X、Y、Z、M、N、O均为短周期主族元素,且原子序数依次增大。已知X常见离子相当于一个裸露的质子,Y元素原子最外层电子数与核外电子总数之比为3∶4,N元素原子的最外层电子数与次外层电子数之比为3∶4,Z、M、O位于同一周期,三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水.
据此回答下列问题:
(1)写出下列元素的符号:X________;Z________;M_________;N___________。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_______(分解反应)。
(3)X、Z可以形成一种离子化合物,在该化合物中Z为+1价,可以和水反应生成氢气,写出该化合物和水反应的化学方程式:____。
(4)Z、M两种元素最高价氧化物的水化物之间反应的化学方程式为_____。
(5)下列事实能说明元素O的非金属性比元素N的非金属性强的是_______。
a.元素O形成的单质比元素N形成的单质的熔点低
b.O和N两元素的简单氢化物受热分解,前者的分解温度高
c.O2通入到X2N的溶液中出现浑浊
查看答案和解析>>
科目: 来源: 题型:
【题目】著名化学家徐光宪,因为在稀土萃取领域取得的卓越成就被誉为“稀土界的袁隆平”;2009 年,胡锦涛 主席为其颁发了“国家最高科学技术奖”。稀土元素是指镧系的 15 种元素,加上钪和钇共 17 种元素。下列 说法正确的是
A. 稀土元素全部是金属元素 B. 要萃取出碘酒中的碘可用 KOH 溶液做萃取剂
C. 镧系元素属于主族元素 D. 某些稀土元素在地壳中的含量高于铁
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制硝基苯的主要步骤如下:
① 在250mL的圆底烧瓶中放入17.7 mL苯,配上一个双孔橡皮塞,一个孔插入一支100℃温度计,其水银球要进入液面下,另一个孔插入长颈漏斗,仪器装置如图所示。

②通过长颈漏斗上口将已配制好的混酸分多次加入烧瓶中。每加一次,必须振荡烧瓶,当反应物温度不再上升而趋下降时,才可继续加混酸。反应温度应保持在40—50℃,若超过50℃,可用冷水浴冷却烧瓶,加料完毕后,把烧瓶放在水浴上加热,约10分钟内把水浴加热到55-60℃,并保持30分钟,间歇地振荡烧瓶。
③冷却后将反应物倒入分液漏斗,静置分层,分出酸液和粗硝基苯,由于工业浓H2SO4中含有少量汞盐等杂质有催化作用,使反应产物中含有苦味酸(2,4,6-三硝基苯酚)和2,4-二硝基苯酚使粗硝基苯呈浅黄色,此外还含有间二硝基苯。已知:苦味酸与2,4-二硝基苯酚均有酸性,能与碱反应;间二硝基苯性质与硝基苯类似。请回答下列问题
(1)步骤①中长颈漏斗的作用
a _______________________,b _______________。
(2)步骤 ②中,每加入一次混酸,必须振荡烧瓶的目的_____________________。
(3)步骤②中,需严格控制温度的原因___________________________________。
(4)步骤③中,静置分层后,粗硝基苯在分液漏斗_____ 层。
(5)要将粗硝基苯中混有少量酸液、苦味酸、2,4一二硝基苯酚以及二硝基苯,除去得到纯净的硝基苯必须进行的五步操作名称为a __________ 、 b _____________、c _________ 、 d _____________、e_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用KClO3在H2SO4存在下与SO2反应制得ClO2。请写出反应的离子方程式:______。
(2)把ag固体NaHCO3加热分解一段时间后,固体质量变为b g。
①尚未分解的NaHCO3质量为________g。
②当b为________g时,表明NaHCO3完全分解。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
①上述反应中氧化剂是__________________。
②根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、
③淀粉、④白酒、⑤食醋,你认为必须选用的物质有___________(填序号)。
③某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号)。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
④请配平以下化学方程式:________□Al+□NaNO3+□NaOH===□NaAlO2+□N2↑+2H2O。若反应过程中转移5 mole-,则生成标准状况下N2的体积为________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的说法正确的是
A. 不能与酸反应的氧化物一定能跟碱反应
B. 能与金属镁反应产生氢气的溶液一定是酸溶液
C. 一种元素可能有多种氧化物,同种化合价也可能对应多种氧化物
D. 酸性氧化物肯定是非金属氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】铅的单质、氧化物、铅盐在现代工业中有着重要的用途。
(1)工业利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下[已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。

①生产过程中,必须使浸出渣中仍含少量的铅单质,其目的是_________,废液中存在可循环利用于的物质,该物质是_______ , 加40%硫酸的目的是 _______
②写出酸浸过程中单质铅反应的化学方程式:______,若沉淀物含有极少量CaSO4,则洗涤剂最好使用____
a.水 b.10%硫酸、水 c.Pb(NO3)2溶液、水
(2)已知铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2以及Pb3O4。Pb3O4能与硝酸发生非氧化还原反应生成一种盐和一种铅的氧化物,写出反应的化学方程式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为周期表前20号元素中某些元素的有关数据:
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
最高价态 | +1 | +1 | —— | +1 | +4 | +5 | +7 | +1 | +5 | —— |
最低价态 | —— | —— | -2 | -1 | -4 | -3 | -1 | —— | -3 | -1 |
试回答下列问题:(用对应的元素符号或物质的化学式表示)
(1)写出⑧的原子结构示意图:________;
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最外层为8电子稳定结构的物质可能是______、____;
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是___________。
(4)以上10种元素的原子中,还原性最强的是__________(元素符号)。
(5)③、⑦、①、⑩四种元素形成的离子,其半径由小到大的顺序为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请用下列仪器和药品组成一套由含有硫化钙杂质的电石进行乙炔气体的制备、净化、检验,并可通过计算确定乙炔产率的系列实验装置,溴水的浓度为0.1 mol/L,体积是20mL,NaOH溶液足量。
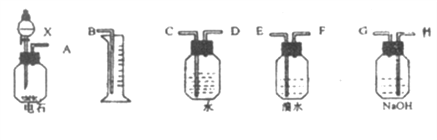
(1)如果所制气体从左到右流向时,进行实验时仪器的正确连接顺序是(填A、B、…) ____ 接 ; 接 ; 接 ; 接 。
(2)为了使实验中气流平稳,液体X通常用_________________________。
(3)实验中盛溴水的瓶中可观察到的现象是_________________________。
(4)假定溴水与乙炔完全反应,生成C2H2Br4,用含amol碳化钙的电石Wg与足量X反应,反应完全后,量筒内排入了VL液体(在标准状况下测定),则乙炔的产率为_____________________(只需列出算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用某些有机物的同分异构体间的转化可用来贮存热能,如原降冰片二烯(NBD)经太阳照射后转化成四环烷(Q)的的反应:![]() △H=+88.62kJ·mol—1 ,下列说法不正确的是:
△H=+88.62kJ·mol—1 ,下列说法不正确的是:
A. NBD、Q、甲苯三者互为同系物
B. NBD、Q、甲苯三者是同分异构体
C. 92gNBD经太阳照射后完全转化为Q时需吸收88.62kJ热量
D. NBD可开发为贮能材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com