
科目: 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
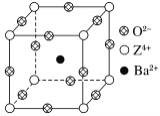
(1) Y在周期表中位于______________;Z4+的核外电子排布式为___________________。
(2)X的该种氢化物分子构型为________,X在该氢化物中以_______方式杂化。X和Y形成的化合物的熔点应该_______(填“高于”或“低于”)X氢化物的熔点。
(3)①制备M的化学方程式是_____________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____ m。
查看答案和解析>>
科目: 来源: 题型:
【题目】同学们在实验室里用不同的方法分别制取Cu(NO3)2,并在此基础上探究Cu(NO3)2的化学性质。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,反应的化学方程式是_____________。
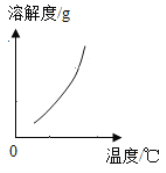
(2)乙组同学查阅了硝酸铜晶体的溶解度曲线(右图),据此设计了以下实验方案,先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、____________、过滤、洗涤、干燥。乙组同学认为此方案优于甲组的方案,理由之一是__________________________。
(3)丙组同学用Cu(NO3)2晶体,探究其热稳定性,实验装置如下所示。(夹持装置和加热仪器未画出)

①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,红棕色气体是____________。
②集气瓶最终被水充满,无气体剩余,则晶体分解的生成的气体还有________。
③欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解],实验方案是 _________。
④由该实验可得出的结论是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A. NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-![]() BaCO3↓+CO32-+2H2O
BaCO3↓+CO32-+2H2O
B. 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO—![]() CaSO3↓+2HClO
CaSO3↓+2HClO
C. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
D. 电解饱和食盐水获取烧碱和氯气: 2Cl—+ 2H2O![]() H2↑+ Cl2↑+2OH—
H2↑+ Cl2↑+2OH—
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
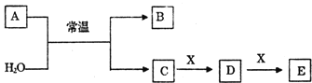
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式________________________________________。
(2)若A为电石(CaC2),X为深红棕色液体非金属单质,写出D + X → E反应的化学方程式为________________________________ 。
(3)若A为淡黄色粉末,回答下列问题:
①A与H2O反应的离子方程式为__________________________________ 。
②若X为非金属单质,通常为黑色粉末,写出D的结构式为______________。
③若X为一种造成温室效应的气体.则鉴别等浓度的D、E两种溶液,可选择的试剂为_________。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X为常见的金属单质,在溶液D中滴加KSCN溶液会变红色。
①A与H2O反应的化学反应方程式为__________________________________ 。
②指明X 在元素周期表中位置为________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:

已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)盐酸溶解MnCO3的化学方程是______________,滤渣1的主要成分为________________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________________,在CuS和MnS共存的悬浊液中,c(Cu2+)/c(Mn2+)=_____________ (Ksp(CuS)=1.2×10-36,Ksp(MnS)=2.5×10-13)。
(4)在酸性条件下,NaClO3溶液将MnCl2氧化为MnO2,其还原产物为Cl2,该反应的离子方程式为 ___________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ________ ;
(2)表中能形成两性氢氧化物的元素是 ________ (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式:_________;
(3)③⑦⑩三种元素的阴离子还原性顺序为: _________________;⑦单质的水溶液呈__________色;
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 _______(填物质化学式) ;(提示:同周期元素,从左到右非金属性逐渐增强。)
(5)③元素与⑩元素两者核电荷数之差是 ____________ ;
(6)设计实验方案:比较⑦与⑥单质氧化性的强弱,请将方案填入下表。
实验步骤 | 实验现象与结论 |
____________________ | ____________________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列烷烃:①CH3(CH2)2CH3、②CH3(CH2)3CH3、③(CH3)3CH、④(CH3)2CHCH2CH3,其沸点由高到低排列的顺序是( )
A. ②④①③B. ④②③①C. ④②①③D. ②④③①
查看答案和解析>>
科目: 来源: 题型:
【题目】关于化学反应的实质的说法不正确的是
A. 化学反应都有新物质生成
B. 化学反应都有能量变化
C. 化学反应是旧键断裂新键生成的过程
D. 化学反应的发生都需要在一定条件下
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求填空:
(1)由1H216O与2H217O所代表的物质中,共有__________种元素,_________种原子,16O、17O的关系为________。
(2)红热木炭放入浓硫酸产生气体过程的化学反应方程式______________________。
(3)硫酸型酸雨产生的原因________________________________(化学方程式)
(4)SO2通入酸性高锰酸钾溶液中的离子方程式____________________________
(5)现有2.96 g铁的硫化物在空气中完全反应,生成2.40 g红色粉末(Fe2O3),并放出有刺激性气味的气体。将该气体通入溴水中,溶液褪色。用离子方程式表示溴水褪色的原因:___________________;通过计算,该铁的硫化物化学式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
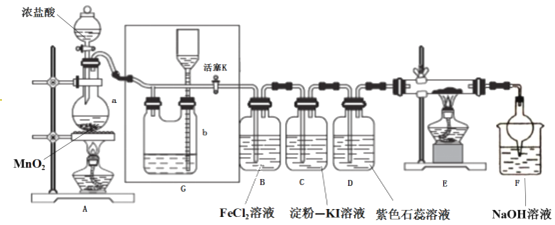
(1)A中发生反应的化学反应方程式为_________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 __________________ 、_______________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)实验结束后,某同学想检验B瓶内液体是否完全与Cl2反应,可采用的方法是: __________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com