
科目: 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分,将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
[提出猜想]
猜想1:该气体为CO2;
猜想2:该气体为SO2;
猜想3:_________________________________________。
为了验证猜想,该小组设计实验加以探究:
[实验探究]该小组同学按如图所示装置,将气体从a端通入,则
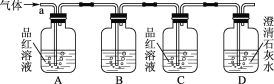
(1)B中应该装下列________试剂(填编号)。
A.NaCl溶液 B.酸性KMnO4溶液 C.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是____________________________________。
(3)D中澄清石灰水的作用是________________________________________。
通过该实验,该小组同学观察到以下三个实验现象:①A中品红溶液褪色;②C中品红溶液不褪色;③D中澄清石灰水变浑浊,由上述现象该小组同学确认该气体的成分为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纯净的氮化镁(Mg3N2)是淡黄色固体,热稳定性较好,遇水极易发生反应。某同学初步设计了如下实验装置制备氮化镁(夹持及加热仪器没有画出)。
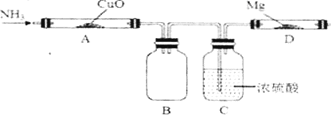
己知:Mg + 2NH3→Mg(NH2)2+H2。请回答:
(1)A中观察到的实验现象是_____________,装置C的作用除了干燥以外还有________________;
(2)下列说法不正确的是 __________
A.为了得到纯净的氮化镁,实验前需要排除装置中的空气
B.装B起到了缓冲安全的作用
C.将装罝B、C简化成装有碱石灰的U型管,也能达到实验目的
D.实验后,取D中固体加少量水,能生成使湿润的蓝色石蕊试纸变红的气体
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取氯气的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。请分别用双线桥法和单线桥法分析该反应中电子转移的方向和数目:
MnCl2+Cl2↑+2H2O。请分别用双线桥法和单线桥法分析该反应中电子转移的方向和数目:
双线桥:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
__________________________________________
单线桥:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
___________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D、E、F六种主族元素,A、B同周期相邻,A、C同主族相邻,A、B、C三种元素的原子序数之和为31,D元素与A、B、C三种元素既不同周期也不同主族,但D单质与A、B、C单质均可以反应,E是短周期主族中原子半径最大的元素,F是B同周期相邻元素。回答下列问题:
(1)写出C的元素符号:_______________ D在周期表中的位置____________________ 。
(2)B、D可直接化合生成化合物x, x分子与A、D形成的分子的稳定性比较_____________________________。(用化学式表示)
(3)A、B、D可组成离子化合物y的化学式为__________;E与C按1:1形成的化合物的电子式为____________ 。
(4)A、C形成的一种既有氧化性又有还原性的常见化合物,它对环境的影响之一是__________________________。
(5) 标准状况下9g F与A的单质完全燃烧产生的气体通入到1 L 1 mol·L-1的NaOH 溶液中,完全反应后溶液中存在的主要离子是_____________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】对右图两种化合物的结构或性质描述正确的是

A. 不是同分异构体
B. 两者分子中所含官能团数目相同
C. 均能与溴水反应
D. 可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目: 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
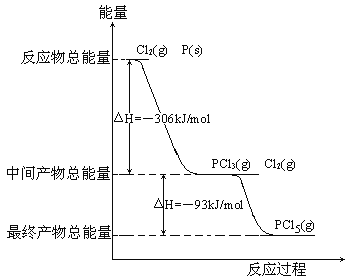
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列各题:
(1)画出Li2O的电子式________________________
(2)用电子式表示CO2分子的形成过程_________________________________________
(3)画出N2分子的结构式_________________
(4)写出全部是由H、O、S、K四种元素形成的两种盐相互反应的离子方程式__________
(5)第3周期的两种金属氧化物对应的水化物间能相互发生反应,写出其化学反应方程式_____________
(6)如图是元素周期表的一个方格  ,其中19.00的意义是___________
,其中19.00的意义是___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com