
科目: 来源: 题型:
【题目】20℃时,NaCl溶解于水的实验数据如下表所示
实验序号 | 水的质量/g | 加入的NaCl质量/g | 未溶的NaCl质量/g |
10 | 2 | 0 | |
10 | 3 | 0 | |
10 | 4 | 0.4 |
下列叙述正确的是( )
A. 实验①所得的溶液为饱和溶液 B. 实验②所得的溶液为饱和溶液
C. 20℃时NaCl的溶解度为30g D. 实验①所得溶液的溶质质量分数为16.7%
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)指出反应的类型:A→C:_________________;
(2)在A~E五种物质中,互为同分异构体的是________________(填代号);
(3)写出由A生成B的化学方程式:_____________________________;
(4)写出D与NaOH溶液共热反应的化学方程式_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于2 mol氨气,下列说法正确的是
A. 质量为17 g
B. 含有6.02×![]() 个NH3分子
个NH3分子
C. 标准状况下的体积为44.8 L
D. 溶于1 L水后,溶液中NH4+的浓度为2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】美国药物学家最近合成种可治疗高血压的有机物K,其合成路线如图所示。

已知:①A的核磁共振氢谱中只有1组峰;
②G和H按物质的量之比1:3反应生成I;
③R1CHO+R2CH2CHO 。
。
(1)A的名称为____________ (用系统命名法命名),由B生成C的反应类型为_______。
(2)写出D的结构简式:______________。
(3)G和H反应生成I的化学方程式为:______________。
(4)E有多种同分异构体,其中既能发生银镜反应又能发生水解反应的有__________种(不考虑立体异构)。
(5)参照上述合成路线,设计一条以G为原料制备1,3-丁二烯CH2=CH-CH=CH2的合成路线_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.
(1)A中产生黄绿色气体,其电子式是 ______;A中使用KMnO4可以在不加热的情况下与浓盐酸发生反应。如果改用二氧化锰,则在加热条件下发生的化学反应方程式为______。
(2)验证氯气的氧化性强于碘的实验现象是 ______ 。
(3)B中溶液发生反应的离子方程式是 ______ 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ______。
(5)过程Ⅲ实验的目的是 ______ 。
(6)实验结论:氯、溴、碘单质的氧化性逐渐 ______ ,原因是:同主族元素从上到下 ______ ,得电子能力逐渐 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列所得溶液的物质的量浓度等于0.1mol/L的是( )
A. 将0.1mol氨气充分溶解在1L水中
B. 将10g质量分数为98%的硫酸与990g水混合
C. 将8g三氧化硫溶于水并配成1L溶液
D. 将0.1mol氧化钾溶于水并配成1L溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】理论上讲,任何自发的氧化还原反应都可以设计成原电池![]() 请你利用下列反应“
请你利用下列反应“![]() ”设计一个化学电池,并回答下列问题:
”设计一个化学电池,并回答下列问题:
①该电池的正极材料是 ______ ,负极材料是 ______ ,电解质溶液是 ______。
②在外电路中,电流方向是从 ______ 极到 ______ 极(填“正”或“负”)。
③正极上出现的现象是 ______ .负极上出现的现象是 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】己二酸主要用于生产尼龙66盐、合成树脂及增塑剂等。已二酸的合成路线如下:

制备己二酸的装置示意图如图所示(加热和夹持装置等略)。
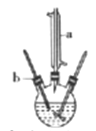
实验步骤:
I.己二酸的制备
连装好装置后,通过瓶口b慢慢滴加1.5g环已醇至适量KMnO4和NaOH的混合溶液中,然后塞上带有温度计的胶塞,再用沸水浴加热数分钟。
II.分离提纯
趁热过滤,收集滤液,用少量热水洗涤滤渣2次,合并滤液和洗涤液,边搅拌边滴加浓盐酸至溶液呈强酸性,小心加热蒸发浓缩至10mL左右,在冷水浴中冷却,析出已二酸粗品。
回答下列问题:
(1)写出仪器a的名称:______________。
(2)分离提纯过程中滴加的浓盐酸的作用是______________。
(3)将已二酸粗品提纯的方法是_______________。
A.过滤 B.萃取 C.重结晶 D.蒸馏
(4)步骤II中过滤时需要用到的玻璃仪器有玻璃棒____、_____。洗涤滤渣的目的是__________。
(5)若制得纯已二酸的质量为1.5g,则己二酸的产率为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:

(1)②表示的元素是 ______ (填元素符号)。
(2)①与⑤两种元素相比较,原子半径较大的是 ______ (填元素符号),其非金属性较强的是 ______ (填元素符号),其最高正价氧化物水化物酸性较强的酸是 ______ (填分子式)。
(3)⑥元素的单质可以用来制取漂白粉,其有效成分是 ______ (填化学式)。③与⑥两种元素所形成化合物的电子式是 ______ 。
(4)写出元素③的最高价氧化物对应的水化物与元素④的最高价氧化物对应的水化物相互反应的化学方程式: ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com