
科目: 来源: 题型:
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
【答案】B
【解析】
NO、CO2的混合气体通过足量的Na2O2发生反应有2Na2O2+2CO2═2Na2CO3+O2、2NO+O2═2NO2,问题的关键在于NO与氧气反应存在着三种可能性,一种情况是恰好反应,一种情况是NO过量,另一种情况可能是O2过量,据此讨论计算。
NO、CO2的混合气体通过足量的Na2O2发生反应有(1)2Na2O2+2CO2═2Na2CO3+O2、(2)2NO+O2═2NO2,假设参加反应的CO2为x mL,NO为ymL,则x+y=10,由方程式得以下关系:
①2CO2+ 2Na2O2= 2Na2CO3+ O2
2mL 1mL
xmL ![]() mL
mL
②2NO + O2 = 2NO2
2mL 1mL 2mL
ymL ![]() mL
mL
当反应②恰好反应时,即当y=x时(此时x、y都等于5),生成的NO2的体积为5mL,显然符合题意,A正确;当y>x时,NO有过量,O2反应完,此时反应掉的NO为xmL,则剩余的NO为(ymL-xmL),生成的NO2气体为xmL,因此反应最后得到的混合气体为NO和NO2,其体积和为(ymL-xmL)+xmL=ymL,结合x+y=10,再根据NO过量的前提条件为y>x,可以得出结论y>5,这与题意“气体体积缩小为5mL”不符,B错误;当y<x时,NO不足,O2过量,此时反应掉的O2为![]() mL,剩余的O2为(
mL,剩余的O2为(![]() —
—![]() )mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(
)mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(![]() —
—![]() )mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
)mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
【点睛】
本题考查混合物的有关计算,属于讨论型计算,侧重对综合能力的考查,确定反应可能的情况是解答的关键。
【题型】单选题
【结束】
24
【题目】在一定温度和压强下,将一支容积为21mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升一定高度不再变化时,在相同条件下再通入O2,若要使试管内的液面仍保持在原高度,则通入O2的体积为
A. 8.75mL B. 12.25mL
C. 5.25mL D. 10.5mL
查看答案和解析>>
科目: 来源: 题型:
【题目】铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与11.2 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为( )
A. 32 gB. 48 gC. 64 gD. 96 g
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
A. 制取及观察Fe(OH)2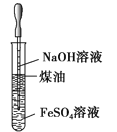
B. 比较两种物质的热稳定性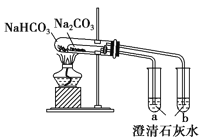
C. 实验室制取NH3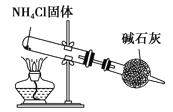
D. 分离沸点不同且互溶的液体混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】在xR2++yH++O2=mR3++nH2O的离子方程式中,对m和R3+的判断正确的是( )
A.m=2 R2+是还原剂B.m=y R3+是氧化产物
C.m=2 R2+是氧化剂D.m=y R3+是还原产物
查看答案和解析>>
科目: 来源: 题型:
【题目】先用特殊方法把固体物质加工成纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子,然后再制成纳米材料是制造纳米材料的一种工艺。下列分散系中的分散质的微粒直径比纳米材料中超细粉末粒子还要小的是
A.悬浊液B.乳浊液C.溶液D.胶体
查看答案和解析>>
科目: 来源: 题型:
【题目】某钠盐溶液可能含有阴离子 NO![]() 、CO
、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-、Br-、I-。为鉴定这些离子,分别取少量溶液进行以下实验:
、Cl-、Br-、I-。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得溶液呈碱性;
②加HCl后,生成无色、无味气体。该气体能使饱和石灰水溶液变浑浊;
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀。
分析上述5个实验,写出每一实验鉴定离子的结论(用“一定有”或“可能有”或“一定没有”来描述,说明理由。)。
(1)实验①_____________________________;
(2)实验②______________________________;
(3)实验③____________________________;
(4)实验④____________________________;
(5)实验⑤____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氯水的叙述,正确的是( )
A. 新制氯水中只含有Cl2和H2O分子
B. 新制氯水可使蓝色石蕊试纸先变红后褪色
C. 光照氯水有气泡逸出,该气体是Cl2
D. 氯水放置数天后,酸性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有 相同的电子数,X元素可以组成M和N两种气态单质,反应M+2I-+2H+=I2+N+H2O常作为M的鉴定反应。
(1)M与N的摩尔质量之比为:______________________。
(2)写出实验室制取W2的离子方程式______________________。
(3)成都七中某化学兴趣小组设计下图所示的实验装置(图中夹持和加热装置略去),分别探究YX2和 W2的性质。

①分别通入YX2和W2时,在装置A中观察到的现象是否相同?___________(填“相同”或“不相同”)。若装置D中装的是铁粉,当通入W2时观察到的现象为______________________;若装置D中装的是五氧化二钒(V2O5),当通入YX2时,打开K放入适量的氧气,在D装置中发生反应的化学方程式为______________________。
②若装置B中装有5.0 mL 1.0×10-3 mol/L的碘水,当通入足量W2完全反应后,转移了 5.0×10-5 mol电 子,该反应的化学方程式为_________________________________。
(4)某同学将足量的YX2通入一支装有BaCl2溶液的试管,未见沉淀生成,向该试管中加入适量(填字母)___________,可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.CaCl2溶液
(5)若Y和X组成的负二价阴离子Z,Z中Y和X的质量比为Y:X =4:3,当W2与含Z的溶液完全反应后,有黄色沉淀生成,取上层淸液加入BaCl2溶液,有白色沉淀产生,且含硫微粒的物质的 量为1:1,该反应的离子方程式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学查阅教材得知,普通锌锰电池筒内无机物质主要成分为MnO2、NH4Cl、ZnCl2等物质。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验:下列有关实验的叙述中,不正确的是

A. 操作①中玻璃棒的作用是加快固体溶解速度
B. 操作②的操作名称是过滤
C. 操作③中盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中杂质
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、D同主族,B、C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素,C原子的质子数比B原子的质子数多2个。请回答下列问题:
(1)B元素的名称为___________,D的元素符号为___________,E的离子结构示意图为___________。
(2)D、E两种元素可形成化学式为DE2、D2E2等化合物,则DE2的电子式为___________________,D2E2的结构式为___________(请填写具体物质的化学式)。
(3)将B2A2投入到B2D的水溶液中可生成D的单质,发生反应的离子方程式为:______________________,请用单线桥标出此反应中电子转移的方向和数目。
(4)DA2与E元素的单质在水中反应的离子方程式为:_________________________________。
(5)向由C、E两种元素组成的化合物溶液400mL1 mol/L中加入500mL—定物质的量浓度的KOH溶液,得到白色沉淀15.6 g,则KOH溶液的物质的量浓度为___________mol/L或___________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com