
科目: 来源: 题型:
【题目】下列说法中不正确的是( )
A. 充电电池不能无限制地反复充电、放电
B. 燃料电池是一种高效且对环境友好的新型电池
C. 化学电池的反应原理是自发的氧化还原反应
D. 铅蓄电池和锌锰干电池都是可充电电池
查看答案和解析>>
科目: 来源: 题型:
【题目】碳族元素( Carbongroup)是位于元素周期表ⅣA族的元素,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)、鈇(Fl)六种。请回答
(1)鈇(Fl),其命名是为了纪念苏联原子物理学家乔治·弗洛伊洛夫,是一种人工合成的放射性化学元素,它的化学符号是Uuq,它的原子序数是____________,属于弱金属之一。
(2)基态锡原子价电子的轨道表示式为________________与其同周期且未成对电子数相同的元素还有______种.
(3)晶体硅的密度为ρg/cm3其晶胞结构与金刚石相似,若硅原子半径为r pm,NA表示阿伏加德罗常数的值,M(Si)表示硅的相对原子质量,则硅晶胞中原子的体积占晶胞体积的百分率为__________用含ρ、r、NA、M(Si)的代数式表示]。
(4)GeO2、SiO2均为共价型化合物,熔点分别为1388K、1983K,则GeO2为______(填晶体类型),SiO2的熔点高于GeO2的原因为______________.
(5)三氯甲烷(Trichloromethane)为无色透明液体。有特殊气味,味甜,低毒,有麻醉性。有致癌可能性。三氯甲烷的VSEPR模型为_____,与三氯甲烷互为等电子体的阴离子为________(任写一种)。
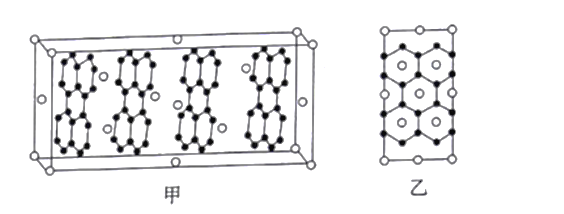
(6)石墨烯研究近年有了长足发展。2017年,清华任天令团队曾首次实现石墨烯智能人工喉,贴附在聋哑人喉部便可以辅助聋哑人“开口说话”。石墨烯与金属R可以形成一种插层化合物。其中R层平行于石墨层,晶胞如图甲所示,其垂直于石墨层方向的投影如图乙所示。则该插层化合物的化学式为________;若碳碳键的键长为apm,则同层最邻近的两个钾原子之间的距离为_________pm。(用含a的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是人类最理想的能源。已知在25℃、101 kPa下,1 g 氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
A.2H2+O2=2H2O ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l)ΔH=-142.9 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)ΔH=+571.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】NOx是造成大气污染的主要物质,现在工业上脱硝有多种方法。试回答下列问题
I.采用NaClO2溶液作为吸收剂可进行脱硝。反应一段时间后溶液中离子浓度的分析结果如下表:

写出NaClO2溶液和NO反应的脱硝过程中主要反应的离子方程式:______________________.
Ⅱ.用焦炭还原法将其转化为无污染的物质也可进行脱硝。已知:
2C(s)+O2(g)=2CO(g) △H1=-221.0kJ·mol-1;
N2(g)+O2(g)=2NO(g) △H2=+180.5kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2 (g) △H3=-746.0kJ /mol
回答下列问题
(1)用焦炭还原NO生成无污染气体的热化学方程式为______________________.
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mo/L)随时间(s)的变化如下表:(已知:三个容器的反应温度分别为T甲=400℃、T乙=400℃、T丙=a℃)

甲容器中,该反应的平衡常数K=_________丙容器的反应温度a__________400℃(填“>”,<”或“=”),理由是___________________________________.,用NH3催化还原NOx,也可以消除氮氧化物的污染。已知:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(l),ΔH<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示
7N2(g)+12H2O(l),ΔH<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示
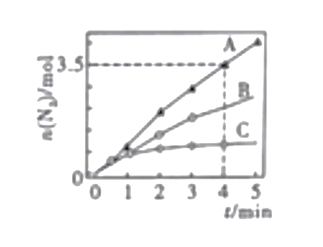
①在催化剂A的作用下0-4min的v(NO2)=___________________.
②该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是_____________,理由是_______________________________________.
③下列说法不正确的是____________(填序号)。
a.使用催化剂A达平衡时,△H值更大
b升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:

(1)实验开始时,关闭K2、开启K1和分液漏斗活寒,滴加苯和液溴的混合液,反应开始。装置II中生成有机物的反应为__________(填化学方程式),装置III中小试管内苯的作用是__________。
(2)能说明苯与液溴发生了取代反应的现象是__________。
(3)反应结束后,要让装置I中的水倒吸入装置II中。这样操作的目的是__________,简述这一操作的方法:______________________________。
(4)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;
②用5%的溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液;
④加入无水CaCl2粉末干燥;
⑤__________(填操作名称).
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组在实验室从海带灰中提取碘并制备KI晶体。
I.碘单质的提取,实验过程如图:

请回答下列问题
(1)操作b的名称是____________.
(2)试剂a可以选用的是____________.(填序号)
A.苯 B. CCl4 C.甘油 D.直馏汽油 E.己烯
Ⅱ.KI晶体的制备,实验装置如图:

实验步骤如下
i.配制0.5moL的KOH溶液。
i.在三颈瓶中加入12.7g研细的单质I2和250mL0.5mol/L的KOH溶液,搅拌至碘完全溶解。
ⅲ通过滴液漏斗向反应后的溶液中滴加适量甲酸,充分反应后, HCOOH被氧化为CO2,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得KI产品14.5g。
请回答下列问题:
(3)配制0.5mol/LKOH溶液时,下列操作导致配得的溶液浓度偏高的是_________(填序号)。
A.托盘上分别放置质量相等的纸片后称量KOH固体
B.KOH固体样品中混有K2O2
C.称量好的固体放入烧杯中溶解未经冷却直接转移入容量瓶
D.未洗涤烧杯及玻璃棒直接向容量瓶中加水定容
E.定容时仰视刻度线
F.定容后摇匀,液面下降,再加水至刻度线
G.定容后摇匀,少量溶液溅出容量瓶
(4)步骤ⅱ中I2与KOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,请写出氧化产物的化学式:____________.
(5)步骤ⅲ中向溶液中滴加适量甲酸时,需打开活塞______________(填“a”“b”或“a和b”)
(6)实验中,加入 HCOOH发生氧化还原反应的离子方程式为___________________________.
(7)实验中KI的产率为________________%(结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. 蚕丝、羊毛的主要成分都是蛋白质
B. 蔗糖、油脂及其水解产物均为非电解质
C. 油脂属于天然高分子化合物
D. 牛奶中加入NaCl溶液,会使蛋白质发生变性
查看答案和解析>>
科目: 来源: 题型:
【题目】胆矾![]() 是一种重要的含铜化合物,某课外研究小组用粗铜(含少量
是一种重要的含铜化合物,某课外研究小组用粗铜(含少量![]() )通过不同的化学反应制取胆矾的过程如图:
)通过不同的化学反应制取胆矾的过程如图:

物质 | 完全沉淀时的pH |
Fe(OH)3 | 3.2 |
Fe(OH)2 | 9.6 |
Cu(OH)2 | 6.4 |
当溶液中被沉淀离子的物质的量浓度小于![]() 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
试回答下列问题:
(1)下列物质中,最适合作为试剂X的是________(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)由粗铜通过两种途径制取胆矾,与途径Ⅱ相比,途径Ⅰ有明显的两个优点,分别是______________、____________________。
(3)试剂Y可以是______________________(任填一种物质的化学式)。
(4)若溶液C中![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() ,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
(5)氢化亚铜![]() 是一种红色固体,40~50℃时,滤液E和
是一种红色固体,40~50℃时,滤液E和![]() 溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5
溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5![]() 个电子,生成CuH的物质的量为________mol。
个电子,生成CuH的物质的量为________mol。
(/span>6)纳米氧化亚铜![]() 是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成
是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成![]() 的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
(7)得到![]() 晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
(4)一种钛镍合金的立方晶胞结构如图所示:

①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com