
科目: 来源: 题型:
【题目】A、B、C三种不同的物质中均含有同一种元素,它们之间存在如图所示的转化关系(部分反应物及生成物已略去).请回答下列问题:

(1)若常温时B为红棕色气体,C为无色气体,则B生成C的化学方程式:____________________________
(2)若常温时A为气态氢化物,B为淡黄色固体,C为气体,则CO2中混有少量气体C杂质可以用__________来除(写一种即可).
(3)若A为碱性氧化物,B为工业制玻璃的主要原料之一,常温时0.1mol/L的C溶液的pH值为13,则反应①的方程式为_______________________检验A、B、C中共有的金属离子的方法是 ____________。
(4)若常温时A为气体单质,①②③④均为化合反应,C的相对分子质量大于B,则C的电子式为:__________。
(5)若A是第三周期某金属的氧化物,B、C均为正盐且B的水溶液呈酸性,C的水溶液呈碱性。请写出反应③的离子方程式:______________________________________________________。
(6)若反应②③④均为化合反应,反应①为置换反应。当A为一种金属单质时,B中阳离子的检验方法为 ____________________________________________。(写出具体操作过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略)。
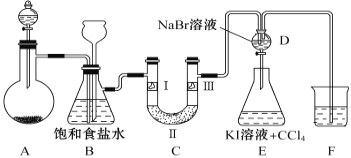
请回答:
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相关反应的化学方程为________________。
(2)装置B中饱和食盐水的作用是____________。同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
选项 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置F烧杯中盛放的试剂是_______________。
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2的氧化性大于Br2。打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________________________________。该现象_____________(填“能”或“不能”)说明Br2 的氧化性强于I2 。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3,充电时选用合适催化剂,仅使Li2CO3发生氧化反应释放出CO2和02。下列说法中正确的是

A. 该电池充电时,阳极反应式为:C+2Li2CO3-4e-=3CO2↑+4Li
B. 该电池放电时,Li+向电极X方向移动
C. 该电池充电时,电极Y与外接直流电源的负极相连
D. 该电池放电时,每转移4mol电子,理论上生成1molC
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,B是非金属性最强的元素,A分别与 B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三种分子中含相同数目的质子,乙常温下为液态化合物, C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)写出B+乙 → 甲+C的化学反应方程式___________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_______。(填写序号)
①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:① 甲与丙以及乙与丙均能够发生反应,
② 甲、丙都是无色、有刺激性气味的物质。据此,请回答下列问题:写出上述第四种元素在周期表中第_________ 周期第_________ 族;写出 C+丙 → 乙+丁 的化学反应方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,恒容的密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),反应过程中某一时刻测得SO2、O2SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,可能出现的数据是
2SO3(g),反应过程中某一时刻测得SO2、O2SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,可能出现的数据是
A. c(O2)=0.3mol/L B. c(SO3)+c(SO2)=0.4 mol/L
C. c(S03)=0.4 mol/L D. c(S03)+c(SO2)=0.15mol/L
查看答案和解析>>
科目: 来源: 题型:
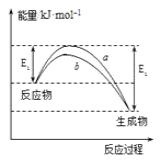
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)这九种元素中,位于第三周期且原子半径最小元素的原子结构示意图_____________。
(2)④、⑤、⑧三种元素中,离子半径由大到小的顺序为__________(填离子符号)。
(3)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
⑧和⑨元素的气态氢化物稳定性顺序为_____________________(填化学式)。
(4)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为____________________________。
(5)①、④、⑤、⑨四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式____________。
(6)元素⑤与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与②的最高价氧化物反应的化学方程式为_____________,②的最高价氧化物的电子式___________。
(7)能说明⑧的非金属性比⑨的非金属性__________(填“强”或“弱”)的事实是________(用离子方程式说明)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:
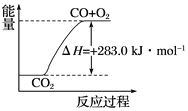
① CO(g)+ ![]() O2(g)=CO2(g) ΔH= -283.0 kJ·mol-1
O2(g)=CO2(g) ΔH= -283.0 kJ·mol-1
② H2(g)+ ![]() O2(g)=H2O(g) ΔH= -241.8 kJ·mol-1
O2(g)=H2O(g) ΔH= -241.8 kJ·mol-1
下列说法正确的是( )
A. 1mol H-H键与0.5mol O=O键的键能之和大于2mol H-O 键的键能总和
B. 由①可知,1 mol CO(g)和 ![]() mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用上图表示 2CO2(g)=2CO(g)+O2(g) 反应过程中的能量变化关系
D. 分解1 mol H2O(g),其反应热为-241.8 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】德国化学家F.Haber利用N2和H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
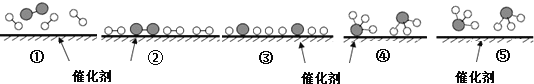
A. 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
B. 催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C. 在该过程中,N2、H2断键形成N原子和H原子
D. 使用催化剂,合成氨反应放出的热量减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com