
科目: 来源: 题型:
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是短周期元素,其原子序数依次增大,周期表中A与B、C与E相邻;A与E的最外层电子数之比2:3,B的最外层电子数比C的最外层电子数少1个;常见化合物![]() 与水反应生成C的单质,且溶液使酚酞试液变红。
与水反应生成C的单质,且溶液使酚酞试液变红。
(1)E的元素名称是 ________;该元素在周期表中的位置为__________
(2)A、B、C的氢化物稳定性由弱到强的顺序为(用分子式表示)________ ;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中所含化学键的类型为 _______
(3)写出![]() 的电子式 _____。用电子式表示只含D、E两种元素的化合物的形成过程________
的电子式 _____。用电子式表示只含D、E两种元素的化合物的形成过程________
(4)写出![]() 与
与![]() 反应的离子方程式 _______________________________。
反应的离子方程式 _______________________________。
(5)将化合物B H3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硒的原子序数为34,是硫的同主族元素,硒的单质及其化合物用途非常广泛。
(1)硒位于周期表第______,周期___族。Se2Cl2常用作分析试剂,其电子式为_______。
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HC1O与Cu2Se的物质的量之比为____。用氨水中和亚硒酸后得到亚硒酸铵,再向( NH4)2SeO3溶液中加入Na2S2O3可得到纳米硒,同时生成亚硫酸盐,(NH4)2SeO3与Na2S2O3反应生成纳米硒的离子方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,断裂1molN≡N吸收942kJ热量.根据以上信息和数据,下列说法正确的是( )

A. N4属于一种新型的化合物,与N2互为同素异形体
B. N4的沸点比白磷(P4)的高
C. 1mol N4转化为2mol N2的同时放出能量
D. 相同质量的N4和 N2所含原子个数比为1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
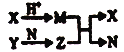
A. 相对分子质量M>N,沸点M>N B. 简单离子半径:D>B>C>A
C. Z 为 Na2CO3 D. 图中有两个氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修5:有机化学基础]
H是一种新型香料的主要成分之一,其合成路线如下所示(部分产物和部分反应条件略去):

已知:①RCH=CH2+CH2===CHR′![]() CH2===CH2+RCH===CHR′;
CH2===CH2+RCH===CHR′;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
请回答下列问题:
(1)(CH3)2CCH2的同分异构体中存在顺反异构的有机物的名称为____。
(2)A的核磁共振氢谱除苯环上的H外,还显示____组峰,峰面积比为___。
(3)D分子含有的含氧官能团的名称是___,E的结构简式为____。
(4)CH2===CH2发生加聚反应的化学方程式为____;D和G反应生成H的化学方程式为____。
(5)G的同分异构体中,同时满足下列条件的有____种(不包括立体异构)。
①苯的二取代物 ②与FeCl3溶液发生显色反应 ③含“—COO—”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3-丁二醇的合成路线。_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为______;价电子中成对电子数有____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是_________。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3___H3PO4(填“>”或“<”),从结构的角度说明理由:__________________________。
(3)磷青铜中的锡、磷两元素电负性的大小为Sn___P(填“>”“<”或“=”)。
(4)某磷青铜晶胞结构如图所示。
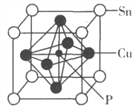
①则其化学式为________。
②该晶体中距离Cu原子最近的Sn原子有______个,这些Sn原子所呈现的构型为_________。
③若晶体密度为8.82g·cm-3,最近的Cu原子核间距为____pm(用含NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2 LCH2Cl2含极性共价健数目为2NA
B. 1mol甲基(![]() )所含的电子数为7NA
)所含的电子数为7NA
C. 30g葡萄糖和乙酸的混合物中含碳原子数为NA
D. 1 mol有机物![]() 中最多有6NA个原子在一条直线上
中最多有6NA个原子在一条直线上
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 盐酸与
盐酸与![]() 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是____________________。能否改用铜丝_______(填“能、否”),原因是____________________________
(2)大烧杯上如不盖硬纸板,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(3)实验中改用![]() 盐酸跟
盐酸跟![]() 溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替![]() 溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(5)取![]() 溶液和
溶液和![]() 硫酸溶液进行实验,实验数据如下表。
硫酸溶液进行实验,实验数据如下表。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
|
| 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _________________ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
则中和热![]() __________(取小数点后一位。)(本题中
__________(取小数点后一位。)(本题中![]() 溶液和硫酸溶液的密度均取
溶液和硫酸溶液的密度均取![]() ,中和后生成溶液的比热容取
,中和后生成溶液的比热容取![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com