
科目: 来源: 题型:
【题目】下列关于Fe3+、Fe2+性质实验的说法错误的是( )

A. 用如图装置可以制备Fe(OH)2沉淀
B. 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C. 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+
D. 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下列仪器和药品制取干燥纯净的氯气:

(1)请写出氯元素在元素周期表中的位置______________________;
(2)按气流从左到右,装置正确的连接为a接(___)接(___)接(___)接(___)接(___)接(___) 接g(填各接口字母);
(3)装置A中反应的化学方程式为_____________________________________________;
(4)装置C的作用是____________________,装置E的作用是_____________________;
(5)装置D中反应的离子方程式为______________________________________________;
(6)某校化学兴趣小组称取8.7 g二氧化锰与足量10 mol·L-1的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1=___________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟,D是日常生活中常见的盐(部分反应物和生成物及溶剂水已略去)。

请回答下列问题:
(1)用电子式表示D的形成过程_________________;
(2)C的电子式为______________________;
(3)写出A溶液和丁反应生成D的离子方程式_________________________________;
(4)写出A和E反应的化学方程式_____________________________________。.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各图为几种晶体或晶胞的构型示意图。
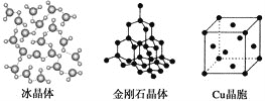
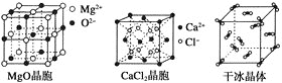
请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是___________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.下图甲、乙、丙均为验证铜和浓硝酸反应的装置:

(1)甲、乙、丙三个装置中共同发生的化学方程式是___________________。
(2)和甲装置相比,乙装置的优点是
①________________________________________________,
②_______________________________________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭活塞c,再打开活塞a、b,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应该如何操作_________________。
(4)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是_____mol/L (气体体积按标准状况计算)。
II.证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性检查)

实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。 Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是__________________。
(4)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐________,得电子能力逐渐________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是元素周期表的一部分,请回答下列问题:
族/周期 | IA | IIA | III A | IVA | VA | VIA | VIIA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___________________(填元素符号),其⑤的离子结构示意图为____________________。
(2)在这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为____________(填物质的化学式),酸性最强的化合物为________________(填物质的化学式)。
(3)在②和③两种元素中,非金属性较强的是______(填元素名称),②的某种单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是_________________________________,Q、R、T三种元素原子半径由大到小的顺序为________________________。(用元素符号表示),QO2的电子式为___________,比较Q、R的最高价氧化物的水化物的酸性__________________。(填物质的化学式)。
(2)T单质与NaOH 溶液反应的离子方程式为__________________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )

A. 离O点越远的元素原子半径越大
B. 虚线相连的元素处于同一族
C. N点代表的是图中金属性最强的元素
D. M、N点代表的元素组成的化合物中可能含有共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 常温下,78 g Na2O2中含有的阴离子数是2NA
B. 标况下,22.4 L CCl4含有的共价键数是4NA
C. 2.4g镁在足量氧气中燃烧,转移的电子数是0.1NA
D. 铁铝混合物与一定量稀盐酸反应生成1 mol H2时,转移电子数是2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com