
科目: 来源: 题型:
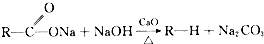
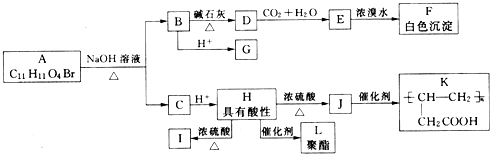


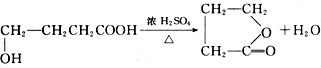

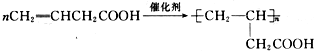
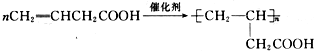
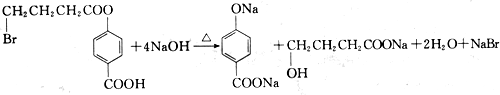

查看答案和解析>>
科目: 来源: 题型:



| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
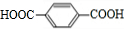 +nHOCH2CH2OH
+nHOCH2CH2OH| 浓硫酸 |
| △ |
 +(2n-1)H2O
+(2n-1)H2O +nHOCH2CH2OH
+nHOCH2CH2OH| 浓硫酸 |
| △ |
 +(2n-1)H2O
+(2n-1)H2O查看答案和解析>>
科目: 来源: 题型:
能正确表示下列反应的离子反应式的是( )
A.氯气跟溴化钠溶液反应
2NaBr+Cl2=2NaCl+Br2
B.过量三氯化铁溶液跟锌反应:
Fe3++Zn=Fe2++Zn2+
C.硝酸跟氢氧化钠溶液反应:
H++OH—=H2O
D.氯化铵溶液跟氢氧化钠溶液反应
NH4++OH—=NH3·H2O
查看答案和解析>>
科目: 来源: 题型:阅读理解
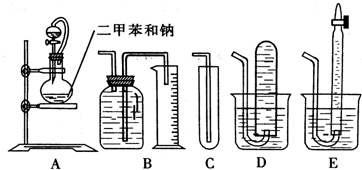
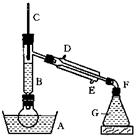 溴乙烷的沸点是38.4℃,密度是1.46g/cm3.如图为实验室制备溴乙烷的装置示意图(夹持仪器已略去).A-水浴加热装置,B-分馏柱,C-温度计,F-接液管,G-中盛蒸馏水.在圆底烧瓶中依次加入溴化钠、适量水、95%乙醇和浓H2SO4.边反应边蒸馏,蒸出的溴乙烷用水下收集法获得.可能发生的副反应:H2SO4(浓)+2HBr=Br2+SO2+2H2O
溴乙烷的沸点是38.4℃,密度是1.46g/cm3.如图为实验室制备溴乙烷的装置示意图(夹持仪器已略去).A-水浴加热装置,B-分馏柱,C-温度计,F-接液管,G-中盛蒸馏水.在圆底烧瓶中依次加入溴化钠、适量水、95%乙醇和浓H2SO4.边反应边蒸馏,蒸出的溴乙烷用水下收集法获得.可能发生的副反应:H2SO4(浓)+2HBr=Br2+SO2+2H2O| △ |
| △ |
查看答案和解析>>
科目: 来源: 题型:
| ||
|
| ||
|
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 |
密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-34.0℃ 不能导电 |
密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |
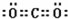
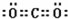
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
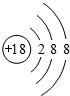

查看答案和解析>>
科目: 来源: 题型:
表中为一些短周期元素及相应氢化物沸点的数据:
| ||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com