
科目: 来源: 题型:
【题目】根据下列操作及现象,所得结论不正确的是![]()
![]()
序号 | 操作及现象 | 结论 |
A | 将 |
|
B | “ |
|
C | 向25mL冷水和沸水中分别滴入5滴 | 温度升高, |
D | 将固体 | 同温下溶解度:
|
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】对化学反应限度的叙述,错误的是 ( )
A. 任何可逆反应都有一定的限度
B. 化学反应达到限度时,正逆反应速率相等
C. 化学反应的限度与时间的长短无关
D. 化学反应的限度是不可改变的
查看答案和解析>>
科目: 来源: 题型:
【题目】以电镀污泥[主要成分为Cu(OH)2、Cu2(OH)2CO3、Fe(OH)3和SiO2等]为原料制备纳米铜等的工艺流程如下:

(1)“浸取”时,工业上采用3 mol·L-1H2SO4溶液在室温下浸取1 h。
①Cu2(OH)2CO3被浸取的化学方程式为______________________________________;
②下列措施可提高铜和铁的浸取率的是________(填字母)。
a.将电镀污泥浆化处理 b.适当增大液、固质量比
c.浸取时间缩短一半 d.控制浸取终点pH>3
(2)“萃取”时,两种金属离子萃取率与pH的关系如图甲所示。当pH>1.7时,pH越大金属离子萃取率越低,其中Fe3+萃取率降低的原因是_____________________________________________________________。

(3)“反萃取”得到CuSO4溶液制备纳米铜粉时,Cu2+的还原率随温度的变化如图乙所示。
①该反应的离子方程式为____________________________________________;
②在20~75 ℃区间内,温度越高Cu2+的还原率也越高,其原因是 ____________________。
(4)在萃取后的“水相”中加入适量氨水,静置,再经_____________等操作可得到Fe2O3产品。
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含![]() 废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的
废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的![]() 和
和![]() 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室![]() 下列叙述正确的是
下列叙述正确的是![]()
![]()
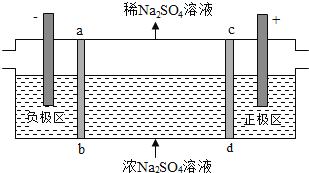
A. 通电后中间隔室的![]() 离子向正极迁移,正极区溶液pH增大
离子向正极迁移,正极区溶液pH增大
B. 该法在处理含![]() 废水时可以得到NaOH和
废水时可以得到NaOH和![]() 产品
产品
C. 负极反应为![]() ,负极区溶液pH降低
,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有![]() 的
的![]() 生成
生成
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:

(1)在①-元素中,金属性最强的元素是_________(用元素符号表示,下同),该单质与水反应的化学方程式为___________________________________;气态氢化物最稳定的元素是___________;最不活泼的元素_________;常温下单质为液态的非金属元素是_________;两性金属是__________,它与氢氧化钠溶液反应的离子方程式为: ___________________________________。
(2)元素⑦与元素⑧相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d. ⑧的最高价氧化物对应的水化物酸性比⑦的最高价氧化物对应的水化物酸性弱
(3)①的氢化物的化学式是__________,它的沸点高于同主族其他元素的氢化物,原因是:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在某透明溶液中,能大量共存的离子组是( )
A.K+、MnO4-、SO42-B.Ba2+、Cl-、SO42-
C.Na+、CO32-、H+D.OH-、Na+、Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)![]() 2C(g)+D(s)
2C(g)+D(s)
△H=a kJ/mol实验内容和结果分别如下表和右图所示。下列说法正确的是
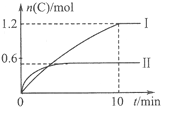
实验 序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
Ⅱ | 800℃ | 1.5mol | 0.5mol | - |
A. 实验Ⅰ中,10min内平均速率v(B)=0.06mol/(L·min);
B. 上述方程式中a=-160
C. 600℃时,该反应的平衡常数是1.5
D. 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com