
科目: 来源: 题型:
【题目】砷![]() 是第四周期ⅤA族元素,可以形成
是第四周期ⅤA族元素,可以形成![]() 、
、![]() 、
、![]() 、
、![]() 等 化合物,有着广泛的用途
等 化合物,有着广泛的用途![]() 回答下列问题:
回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣![]() 主要成分为
主要成分为![]() 制成浆状,通入
制成浆状,通入![]() 氧化,生成
氧化,生成![]() 和单质硫
和单质硫![]() 写出发生反应的化学方程式 _____________________________________________
写出发生反应的化学方程式 _____________________________________________ ![]() 该反应需要在加压下进行,原因是 _______________________________________
该反应需要在加压下进行,原因是 _______________________________________
(3)已知:![]()
![]()
![]()
则反应![]() 的
的![]() ________________________
________________________
(4)![]() 时,将
时,将![]() 、
、![]()
![]() 和20mLNaOH溶液混合,发生反应:
和20mLNaOH溶液混合,发生反应:![]() 溶液中
溶液中![]() 与反应时间
与反应时间![]() 的关系如图所示.
的关系如图所示.
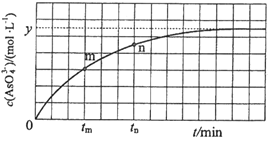
①下列可判断反应达到平衡的是 ______ ![]() 填标号
填标号![]() .
.
![]() 溶液的pH不再变化
溶液的pH不再变化 ![]()
![]()
![]() 不再变化
不再变化 ![]()
![]()
②![]() 时,
时,![]() ______
______![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]()
③![]() 时,
时,![]() ______
______![]() 时
时![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() ,理由是 ____________________
,理由是 ____________________
④若平衡时溶液的![]() ,则该反应的平衡常数K为 ______________
,则该反应的平衡常数K为 ______________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )
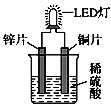
A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 电路中的电流方向由锌片流向铜片
C. 其能量转化的形式主要是“化学能→电能→光能”
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铬![]() 在溶液中主要以
在溶液中主要以![]() 蓝紫色
蓝紫色![]() 、
、![]() 绿色
绿色![]() 、
、![]() 橙红色
橙红色![]() 、
、![]() 黄色
黄色![]() 等形式存在,
等形式存在,![]() 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(1)![]() 与
与![]() 的化学性质相似,在
的化学性质相似,在![]() 溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
(2)![]() 和
和![]() 在溶液中可相互转化
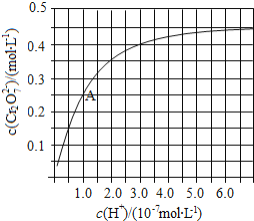
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示.
的变化如图所示.
![]() 用离子方程式表示
用离子方程式表示![]() 溶液中的转化反应______________________________ .
溶液中的转化反应______________________________ .
![]() 由图可知,溶液酸性增大,
由图可知,溶液酸性增大,![]() 的平衡转化率__________________
的平衡转化率__________________ ![]() 填“增大“减 小”或“不变”
填“增大“减 小”或“不变”![]() 根据A点数据,计算出该转化反应的平衡常数为 _______________ .
根据A点数据,计算出该转化反应的平衡常数为 _______________ .
![]() 升高温度,溶液中
升高温度,溶液中![]() 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的![]() ______
______ ![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() .
.
(3)在化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点
生成砖红色沉淀,指示到达滴定终点![]() 当溶液中
当溶液中![]() 恰好完全沉淀
恰好完全沉淀![]() 浓度等于
浓度等于![]() 时,溶液中
时,溶液中![]() 为 ______
为 ______ ![]() ,此时溶液中
,此时溶液中![]() 等于 ______
等于 ______ ![]() 已知
已知![]() 、AgCl的
、AgCl的![]() 分别为
分别为![]() 和
和![]()
(4)![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,反应的离子方程式为 _________________________________________________ .
,反应的离子方程式为 _________________________________________________ .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中含有共价键的离子化合物是( )
①MgF2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦N2
A. ②③④ B. ②④⑤⑦ C. ①②③④⑥ D. ①③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用![]() 回答下列问题:
回答下列问题:
(1)久存的银制品表面会变黑,失去银白色光泽,原因是 ____________________ .
(2)已知![]() ,若向
,若向![]() 的
的![]() 溶液中加入
溶液中加入![]() 的盐酸,混合后溶液中
的盐酸,混合后溶液中![]() 的浓度为 ______________
的浓度为 ______________ ![]() ,pH为 _______________ .
,pH为 _______________ .
(3)![]() 光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为 _______________________________________ .
光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为 _______________________________________ .
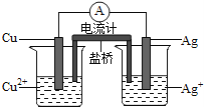
(4)如图所示原电池正极的反应式为________________________________________ .
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.为了实验验证镁和铝的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
(1)以上两实验方案实验现象较为明显的是_____________。
(2)学生乙在实验中取了一段黑色的镁带,投入稀盐酸中,现象不十分明显,请分析原因_________________。
Ⅱ. (3) 向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________。
Ⅲ.利用如图装置可验证同主族元素非金属性的变化规律。

(4)仪器B的名称为__________,干燥管D的作用是__________________。
(5)若要证明非金属性: Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉—碘化钾混合溶液,观察到C中溶液_____________________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____________溶液吸收尾气。
(6)若要证明非金属性: C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液。观察到C中溶液______________________(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有__________________溶液的洗气瓶除去。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,![]() 的捕集利用技术成为研究的重点.完成下列填空:
的捕集利用技术成为研究的重点.完成下列填空:
(1)目前国际空间站处理![]() 的一个重要方法是将
的一个重要方法是将![]() 还原,所涉及的反应方程式为:
还原,所涉及的反应方程式为:![]()
已知![]() 的体积分数随温度的升高而增加.若温度从
的体积分数随温度的升高而增加.若温度从![]() 升至
升至![]() ,重新达到平衡,判断下列表格中各物理量的变化
,重新达到平衡,判断下列表格中各物理量的变化![]() 选填“增大”、“减小”或“不变”
选填“增大”、“减小”或“不变”![]()
|
| 平衡常数K | 转化率 |
______ | ______ | ___________ | _______ |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
|
|
|
| |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为 ________________________ .
(3)已知碳酸:![]() ,
,![]() ,
,![]() ;草酸:
;草酸:![]() ,
,![]() ,
,![]() 。
。
则![]() 溶液的pH ____________
溶液的pH ____________ ![]()
![]() 溶液的
溶液的![]() 选填“大于”“小于”或“等于”
选填“大于”“小于”或“等于”![]() 等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是 _______________
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是 _______________ ![]() 若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是 ___________
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是 ___________ ![]() 选填编号
选填编号![]()
![]()
![]()
![]()
![]()
(4)人体血液中的碳酸和碳酸氢盐存在平衡:![]() ,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象 ___________________________________________________ .
,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象 ___________________________________________________ .
查看答案和解析>>
科目: 来源: 题型:
【题目】含Na2SO4、MgSO4和NaNO3的1L混合溶液,已知其中c(Mg2+)=0.4molL-1,c(SO42-)=0.6molL-1,c(NO3-)=0.2molL-1,则此溶液中c(Na+)为( )
A.0.2molL-1B.0.4molL-1
C.0.6molL-1D.0.8molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】镍配合物在传感器、磁记录材料、储氢材料、电极催化剂和化学键研究等方面有着广泛的应用。以纯镍片为原料制备一种镍配合物[Ni(NH3)xCly]Clz·nH2O的主要流程如下:
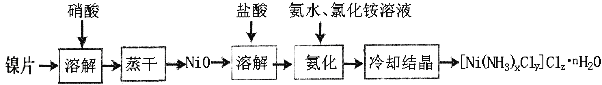
(1)工业上镍氢电池总反应式为:LaNi5H6 + NiOOH ![]() LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
(2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60oC,控温原因可能是_______,写出离子反应方程式:____________________________。
(3)冷却结晶后洗涤、过滤、干燥得到[Ni(NH3)xCly]Clz·nH2O,其中洗涤的正确操作是___________________________________________________________________。
(4)氨化过程中应控制溶液pH范围8~9,其原因是_____________________________。上述流程中,有关说法正确的是___________
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl—)> c(NH3·H2O) >c(NH4+) > c(OH—)> c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(5)为测定化合物[Ni(NH3)xCly]Clz·nH2O的组成,进行如下实验:
实验一:称取样品0.6460 g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00 mL 0.5000 mol·L-1的盐酸完全吸收,并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL,加入指示剂少量,用0.1000 mol·L-1NaOH滴定,消耗NaOH溶液20.00 mL。
实验二:另取该样品0.6460 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应化学方程式为: [Ni(NH3)xCly]Clz+zAgNO3=[Ni (NH3)xCly] (NO3)z+zAgCl↓ 测得该镍配合物的化学式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com