
科目: 来源: 题型:
【题目】下表是元素周期表一部分,列出了十种元素在周期表中的位置:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
3 | ① | ③ | ④ | ⑨ | ||||
4 | ② | ⑩ |
请回答下列问题:
(1)在上述元素中,非金属性最强的是________(填元素名称),原子半径最大的是_____(填元素符号),⑧与⑩两者核电荷数之差是_____________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_______________(填物质化学式)。
<>(3)⑤和⑦可以形成一种温室气体,用电子式表示其形成过程____________________________。(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式:___________,该物质所含化学键类型为__________________,写出X与水反应的离子方程式_____________________ 0.1mol X与水反应转移电子数为 _______________。
(5)表中元素⑥和⑧可形成一种相对分子量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
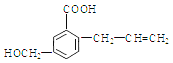
A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是
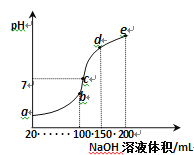
A. b点溶液中离子浓度由大到小的顺序为: c(Na+)>c(SO42—)>c(NH4+)>c(H+)>c(OH-)
B. 图中b、c、d 三点溶液中水的电离程度最大的是c点
C. b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D. pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42—)+c(OH-)
【答案】C
【解析】
试题A.b点表示NH4HSO4溶液与NaOH溶液恰好反应生成硫酸钠、硫酸铵,溶液显酸性,离子浓度由大到小的顺序为:c(Na+)=c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-),故A错误;B.图中b点硫酸铵水解,促进水的电离、c点显中性,生成了部分NH3·H2O,抑制了水的电离、d点氢氧化钠过量,抑制水的电离,三点溶液中水的电离程度最大的是a点,故B错误;C.b点后滴加NaOH溶液过程中,NH3·H2O的浓度逐渐增大,电离程度逐渐减小,故C正确;D.pH=7时,溶液中存在电荷守恒c(H+)+c(Na+)+c(NH
)>c(H+)>c(OH-),故A错误;B.图中b点硫酸铵水解,促进水的电离、c点显中性,生成了部分NH3·H2O,抑制了水的电离、d点氢氧化钠过量,抑制水的电离,三点溶液中水的电离程度最大的是a点,故B错误;C.b点后滴加NaOH溶液过程中,NH3·H2O的浓度逐渐增大,电离程度逐渐减小,故C正确;D.pH=7时,溶液中存在电荷守恒c(H+)+c(Na+)+c(NH![]() )=2c(SO
)=2c(SO![]() )+c(OH-),故D错误;故选C。
)+c(OH-),故D错误;故选C。
考点:考查了弱电解质的电离平衡、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
20
【题目】下列有关电解质溶液的说法正确的是
A.Na2SO3溶液加水稀释后,pH和KW均减小
B.0.1molL﹣1Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3)
C.浓度分别为0.2molL﹣1和0.1molL﹣1的CH3COOH溶液中,c(H+)之比等于2:1
D.室温下,PH=12的氨水与PH=2的H2SO4溶液等体积混合后,溶液呈酸性
【答案】B
【解析】
试题A、由于KW只受温度的影响,故加水稀释时,溶液的pH变小,但Kw不变,故A错误;B、Na2CO3溶液中所有H+和OH﹣均全部来自于水,故根据质子守恒可有:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3),故B正确;C、在相同温度下,将0.2mol/L的CH3COOH溶液加水稀释至原体积的2倍,则浓度变为原来浓度的![]() ,所以稀释后浓度为0.1mol/L,因稀释过程中醋酸电离平衡正向移动,因此0.1mol/L溶液中c(H+)大于原溶液中c(H+)的
,所以稀释后浓度为0.1mol/L,因稀释过程中醋酸电离平衡正向移动,因此0.1mol/L溶液中c(H+)大于原溶液中c(H+)的![]() ,因此前者与后者的c(H+)比值小于2:1,故C错误;D、NH3H2O是弱电解质,不能完全电离,故将PH=12的氨水与PH=2的H2SO4溶液等体积混合后,氨水过量,故所得的溶液为硫酸铵和过量的氨水的混合溶液,溶液显碱性,故D错误.故选B
,因此前者与后者的c(H+)比值小于2:1,故C错误;D、NH3H2O是弱电解质,不能完全电离,故将PH=12的氨水与PH=2的H2SO4溶液等体积混合后,氨水过量,故所得的溶液为硫酸铵和过量的氨水的混合溶液,溶液显碱性,故D错误.故选B
考点:盐类水解的应用;盐类水解的原理;离子浓度大小的比较
【题型】单选题
【结束】
21
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
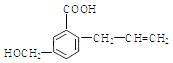
A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
A. 3.6mol/L B. 3.2mol/L C. 2.8mol/L D. 2.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )
A. 7.8g过氧化钠含有的共用电子对数为0.2NA
B. 2H2O2(l)=2H2O(l)+O2(g)ΔH=98.2 kJ/mol,ΔS=70.5 J/mol·K,该反应低温能自发进行
C. 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子
D. 在含有NH4+、Ba2+、Cl—、NO3—离子的溶液 加入少量过氧化钠以上各离子量几乎不减少
【答案】B
【解析】
A.过氧化钠的电子式为![]() ,则7.8g过氧化钠含有的共用电子对为
,则7.8g过氧化钠含有的共用电子对为![]() ×1=0.1mol,故A错误;B.2H2O2(l)=2H2O(l)+O2(g)△H=-98.2kJmol-1,△S=70.5Jmol-1K-1,则△G=△H-T△S<0在任何温度下都小于0,故B正确;C.过氧化氢遇强氧化剂酸性高锰酸钾溶液时,过氧化氢中的氧元素的化合价是-1价可升高为0价,发生还原反应,所以1mol过氧化氢失去2NA电子,故C错误;D.过氧化钠与水反应生成氢氧化钠和氧气,氢氧根与NH4+反应生成氨水,所以NH4+会减小,故D错误;故选B。
×1=0.1mol,故A错误;B.2H2O2(l)=2H2O(l)+O2(g)△H=-98.2kJmol-1,△S=70.5Jmol-1K-1,则△G=△H-T△S<0在任何温度下都小于0,故B正确;C.过氧化氢遇强氧化剂酸性高锰酸钾溶液时,过氧化氢中的氧元素的化合价是-1价可升高为0价,发生还原反应,所以1mol过氧化氢失去2NA电子,故C错误;D.过氧化钠与水反应生成氢氧化钠和氧气,氢氧根与NH4+反应生成氨水,所以NH4+会减小,故D错误;故选B。
【题型】单选题
【结束】
19
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是
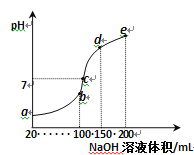
A. b点溶液中离子浓度由大到小的顺序为: c(Na+)>c(SO42—)>c(NH4+)>c(H+)>c(OH-)
B. 图中b、c、d 三点溶液中水的电离程度最大的是c点
C. b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D. pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42—)+c(OH-)
【答案】C
【解析】
试题A.b点表示NH4HSO4溶液与NaOH溶液恰好反应生成硫酸钠、硫酸铵,溶液显酸性,离子浓度由大到小的顺序为:c(Na+)=c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-),故A错误;B.图中b点硫酸铵水解,促进水的电离、c点显中性,生成了部分NH3·H2O,抑制了水的电离、d点氢氧化钠过量,抑制水的电离,三点溶液中水的电离程度最大的是a点,故B错误;C.b点后滴加NaOH溶液过程中,NH3·H2O的浓度逐渐增大,电离程度逐渐减小,故C正确;D.pH=7时,溶液中存在电荷守恒c(H+)+c(Na+)+c(NH
)>c(H+)>c(OH-),故A错误;B.图中b点硫酸铵水解,促进水的电离、c点显中性,生成了部分NH3·H2O,抑制了水的电离、d点氢氧化钠过量,抑制水的电离,三点溶液中水的电离程度最大的是a点,故B错误;C.b点后滴加NaOH溶液过程中,NH3·H2O的浓度逐渐增大,电离程度逐渐减小,故C正确;D.pH=7时,溶液中存在电荷守恒c(H+)+c(Na+)+c(NH![]() )=2c(SO
)=2c(SO![]() )+c(OH-),故D错误;故选C。
)+c(OH-),故D错误;故选C。
考点:考查了弱电解质的电离平衡、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
20
【题目】下列有关电解质溶液的说法正确的是
A.Na2SO3溶液加水稀释后,pH和KW均减小
B.0.1molL﹣1Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3)
C.浓度分别为0.2molL﹣1和0.1molL﹣1的CH3COOH溶液中,c(H+)之比等于2:1
D.室温下,PH=12的氨水与PH=2的H2SO4溶液等体积混合后,溶液呈酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是

①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去
②装置I中充满黄绿色气体后,再加热盛有A铝粉的硬质玻璃管
③装置II是收集装置,用于收集氯化铝
④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同
⑤a处使用较粗的导气管实验时更安全
A. ①② B. ②③⑤ C. ①④ D. ③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】将燃着的镁条伸入盛有二氧化碳的集气瓶中,镁条继续燃烧,反应的化学方程式为CO2+2Mg=C+2MgO,该反应属于:①化合反应 ②分解反应 ③置换反应 ④复分解反应 ⑤氧化还原反应 ⑥离子反应 ⑦非氧化还原反应
A.①③⑦B.②③⑥C.③⑤D.④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是
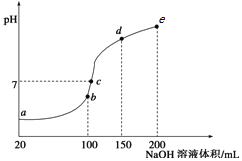
A.b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.图中b、c、d三点溶液中水的电离程度最大的是c点
C.b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D.pH=7时,溶液中c(H+)+c(Na+)+c(NH![]() )=c(SO
)=c(SO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com