
科目: 来源: 题型:
【题目】0.5 mol A元素的最高价离子被还原成中性原子时,要得到6.02×1023个电子。它的单质同盐酸充分反应时,放出0.02g氢气,用去0.4gA;另一元素B的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体。
(1)写出这两种元素符号:A________,B________。
(2)用符号表示A离子结构示意图:A________。
(3)用电子式表示A、B形成化合物的过程:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | F | H | I |
(1)表中元素,化学性质最不活泼的是____,只有负价而无正价的是______,还原性最强的单质是______,氧化性最强的单质是___。
(2)最高价氧化物的水化物中,既能和盐酸又能和氢氧化钠反应的是___,酸性最强的是____,碱性最强的是_____。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的_____。
(4)在A、B、C、D、E、F、G、H中,原子半径最大的是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关氧化还原反应的理解正确的是( )
A. 在一定条件下,氯酸钾与碘发生反应KClO3+I2=2KIO3+Cl2 由此判断氧化性 I2>Cl2
B. 已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O其中1mol氧化剂在反应中得到的电子为12 mol
C. (NH4)2SO4在高温下分解生成 SO2、H2O、N2和 NH3。则该反应的氧化产物:还原产物=1:3
D. 在反应2CuFeS2 + O2 = Cu2S + 2FeS + SO2中,若有1molO2参加反应,则反应中有4mol电子转移
查看答案和解析>>
科目: 来源: 题型:
【题目】对三硫化四磷分子的结构研究表明,该分子中所有原子均以单键连接,且各原子的最外层均已达到8个电子的稳定结构。在一个三硫化四磷分子中含有的共价键的个数是 ( )
A. 19 B. 7 C. 9 D. 不能确定
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z、W、R、Q为前四周期元素,原子序数依次增大。X、Y最外层电子排布可表示为asa,bsbbpb(a≠b),Y、Z、W是位于P区的同一周期的元素,Y与W原子核外的未成对电子数相等,RW2与ZW2-为等电子体,Q为过渡金属元素,其原子核外没有未成对电子。请回答下列问题:
(1)Q的最外层电子排布式为_________ ,RW2的分子立体构型是_________________
(2)Y、Z、W的最简单氢化物中,键角最小的是_______(用分子式表示), YW与Z2互为等电子体,ZW的结构式为____________(若有配位键,请用“→”表示)。
(3)ZX3可以与X+结合成ZX4+,这个过程中发生改变的是____(填序号)。

a.微粒的空间构型 b.Z原子的杂化类型
c.X-Z-X的键角 d.微粒的电子数
(4)QR在荧光体,光导体材料、涂料、颜料等行业中应用广泛。立方QR晶体结构如图所示,一个晶胞中含有的Q原子数为____________。与R原子最近且距离相等的R原子有_____个。该晶胞棱长与最近的两个R原子的距离之比为_______
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z是一种短周期元索,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生右下图转化关系.其中R为10电子分子,是一种常见的无机溶剂。下列说法中不正确的是
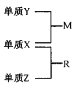
A. X元素位于周期表中第16列
B. X、Y、Z元素两两之间均能形成原子个数比为l:1的化合物
C. X、Y、Z元素形成的单质均具有强还原性
D. R的沸点高于M的沸点
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)操作②为______________________________________________________。
(2)工业合成氨的化学方程式为_____________________。
(3)沉淀池中生成硫酸铵的化学方程式________________________________________。
(4)在实验室中检验氨气的方法是_________________________________。
(5)副产品的化学式为________。该联合生产工艺中可以循环使用的物质是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用有:①共价键 ②离子键 ③分子间的作用力正确的顺序是( )
A. ①②②③ B. ②①②③ C. ②③②① D. ①①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(ClNO)参与大气平流层和对流层的化学,气相的ClNO光解和水解都可产生Cl自由基。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及的化
学反应、对应的反应热和平衡常数如表:
化学反应 | 反应热 | 平衡常数 |
①2NO2(g)+NaC1(s) | △H1 | K1 |
②2NO(g)+C12(g) | △H2 | K2 |
③4NO2(g)+2NaC1(s) | △H3 | K3 |
则K1,K2,K3之间的关系为K2=______________,△H3=_____________
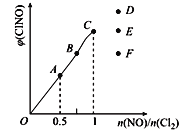
(2)已知2NO(g)+Cl2(g)![]() 2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
2ClNO(g),一定条件下在恒温恒容的密闭容器中按一定比例,充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图,则A、B、C三状态中,NO的转化率最大的是___点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____点。
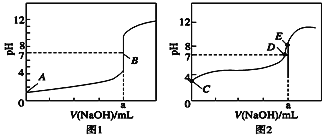
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是______________(填“图1”或“图2”);
②a=______ mL; ③c(Na+)=c(CH3COO-)的点是______点;
④E点对应溶液中离子浓度由大到小的顺序为_______________。
(4) 氨气燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_____________。
(5) 已知:CdCO3、NiCO3溶度积分别为6.0×10-12、1.0×10-7。p(CO32-)=-lg c(CO32-) 。在含Cd2+、Ni2+浓度均为0.01 mol/L的废水中滴加稀碳酸钠溶液。为了分离这两种阳离子,需要控制p(CO32-)范围为_____________(忽略溶液体积的变化)
A.4≤p(CO32-)≤6
B.5<p(CO32-)≤ 7-lg6
C.7-lg6<p(CO32-)≤ 8
D.7<p(CO32-)≤8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com