
科目: 来源: 题型:
【题目】16.8gFe跟一定量浓 HNO3 反应,Fe 全部溶解,共收集NO、NO2的总体积为 11.2 L(标准状况),所得溶液中 H+的物质的量为0.02mol,请回答:
(1)反应中被还原的硝酸为_______mol。
(2)生成的 NO 与 NO2 的物质的量之比为______。
(3)写出该反应的离子方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料,其制备工艺流程如下图所示:
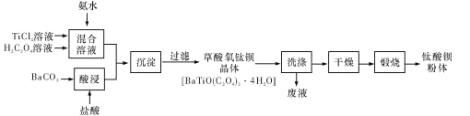
(1)镁的碳化物常见的有MgC2和Mg2C3两种,它们均极易与水发生反应。写出MgC2发生水解反应的化学方程式:_____;Mg2C3的电子式为_____。
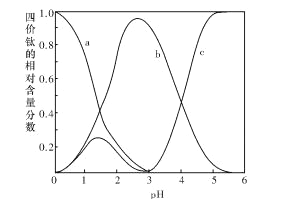
(2)“混合溶液”环节,钛元素在不同pH下主要以种形式存在,如上图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则上图中曲线a对应钛的形式为______填化学符号);写出“沉淀”时的离子方程式:_____。
(3)草酸氧钛钡晶体经蒸馏水数次洗涤后,证明它已被洗涤干净的实验方案为_____。
(4)工业上TiCl4和BaCO3通常用如下方法制备:
①先将金红石(TiO2)与过量焦炭混合,再通入Cl2)并加热到900℃制取TiCl4。请写出该法制备TiCl4的化学方程式:_____。
②BaCO3是将重晶石(主要成分为BaSO4)浸泡在Na2C03溶液中足够长时间来制备。请问Na2CO3溶液的浓度至少要大于_____mol/L才能开始转化。(已知常温下:![]()
![]() ,略CO32-的水解)。
,略CO32-的水解)。
查看答案和解析>>
科目: 来源: 题型:
【题目】太阳能的开发与利用是能源领域的一个重要研究方向,由CO2制取C的太阳能工艺如图所示,下列有关说法正确的是( )

A. 分解1molFe3O4转移电子数为2NA
B. 根据盖斯定律可知,△H1+△H2=0
C. FeO在CO2转化为C的过程中的作用是催化剂
D. 该工艺是将太阳能转化为电能
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用相同物质的量浓度的 HC1 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是

A. 滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH
B. pH= 7 时,c(A+)=c(B+)=c(D+)
C. 滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
D. 当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子一定能够大量共存的是
A.Na+、OH-、SO42-、Fe3+B.K+、SO42-、CO32-、H+
C.Na+、Ca2+、Cl-、CO32-D.Ba2+、Na+、NO3-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH(l) + 3O2(g) → 2CO2 (g) + 4H2O(l),其工作原理示意图如图,下列说法正确的是( )
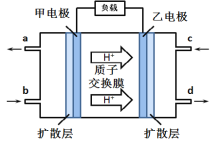
A. 甲为电池的负极,发生还原反应
B. 负极的电极反应式为:CH3OH +H2O-6e-=CO2+6H+
C. b口通入的气体为O2
D. 用该电池进行电解水,当电路中转移0.2NA个电子时,生成2.24L氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
I.将 NaOH溶液与 NH4Cl 溶液混合生成 NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_________。
II.根据下图所示装置图回答以下问题。
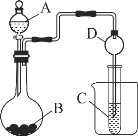
(1)实验室中现有药品Na2S、KMnO4、浓盐酸,某同学验证氯的非金属性大于硫,请写出试管中发的离子反应方程式______
(2)甲同学根据元素非金属性与对应最高价含氧酸之间关系,设计了如图装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;写出选用物质的名称:A__,B__,C___;上述反应的离子方程式_____;_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关乙炔的说法不正确的是( )
A.燃烧时有浓厚的黑烟
B.实验室制乙炔时可用CuSO4除杂质气体
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替
D.乙炔的收集方法可用排空气法收集
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H = + a kJ·mol-l。能判断该分解反应已经达到化学平衡的是( )
2NH3(g)+CO2(g) △H = + a kJ·mol-l。能判断该分解反应已经达到化学平衡的是( )
A. v(NH3)=2v(CO2) B. 密闭容器中NH3体积分数不变
C. 反应吸收a kJ热量 D. 密闭容器中混合气体的密度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com