
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:
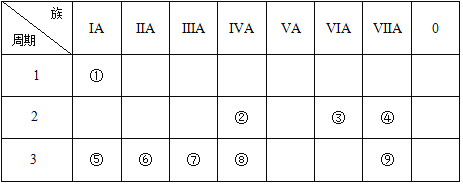
(1)表中用于半导体材料的元素在周期表中的位置__________。
(2)③、④、⑧的原子半径最小是__________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答)。
(5)②和③按原子数1:2形成的化合物的电子式为____,该晶体气化的过程中克服的微粒间作用力为______。
(6)③和⑧形成的化合物属于__________(填“离子化合物”或“共价化合物”),该晶体属于__________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的离子方程式为:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将等体积的0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液混合得到浊液,过滤后进行如下实验:
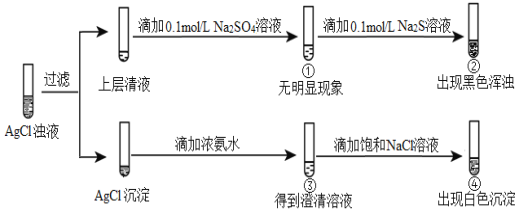
下列分析不正确的是
A. ①的现象说明上层清液中不含Ag+
B. ②的现象说明该温度下Ag2S比Ag2SO4更难溶
C. ③中生成Ag(NH3)2+,促进AgCl(s)溶解平衡正向移动
D. 若向③中滴加一定量的硝酸,也可以出现白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】用O2将HCl转化为Cl2,反应方程式为:4HCl(g) + O2(g)![]() 2H2O(g)+ 2Cl2(g) △H<0。一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是
2H2O(g)+ 2Cl2(g) △H<0。一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是
![]()
A. 2~6 min用Cl2表示的反应速率为0.9 mol/(L·min) B. 增大压强可以提高HCl转化率
C. 平衡常数K(200℃)<K(400℃) D. 0~2 min的反应速率小于4~6 min的反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方案的设计或描述及对应的离子方程式正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B. 将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
C. 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合Ca2+ + 2HCO3- +2OH-=CaCO3↓+CO32-+2H2O
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组比较Cl-、Br-、I- 的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 | 溶液变黄;把湿KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br- D. 上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
查看答案和解析>>
科目: 来源: 题型:
【题目】为探宄固体X(仅含两种常见短周期元素)的组成和性质,设计并完成如下实验:
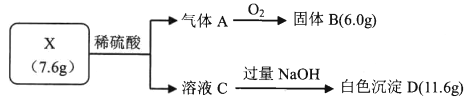
己知:气体A是一种纯净物,在标准状况下的密度为1.429g/L;固体B是光导纤维的主要成分。请回答:
(1)气体A分子的电子式_______,白色沉淀D的化学式_______。
(2)固体X与稀硫酸反应的离子方程式是_______。
(3)己知NH3与气体A在一定条件下反应后可得到一种耐高温陶瓷材料(仅含两种元素,摩尔质量为140g/ mol)和H2,写 出该反应 的化学方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,1 mol/L醋酸加水稀释至0.01 mol/L,关于稀释前后的下列变化正确的是
A. Kw的值减小
B. 溶液中c(OH-)减小
C. pH的变化值等于2
D. 溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释实验事实的方程式正确的是
A. 碳酸钠溶液呈碱性:CO32— + 2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
B. 氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O = 2Fe(OH)3
C. 铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3—=Cu2++2NO2↑+2H2O
D. 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-=2AlO2-+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:A+3B![]() 2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·s),②VB=0.6mol/(L·s),③VC=0.4mol/(L·s),④VD=0.45mol/(L·s),则以上四种情况下反应速率由小到大排列正确的是
2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·s),②VB=0.6mol/(L·s),③VC=0.4mol/(L·s),④VD=0.45mol/(L·s),则以上四种情况下反应速率由小到大排列正确的是
A. ②>④>③>①B. ②>③=④>①
C. ④>②=③>①D. ④>③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com