
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示。请回答:
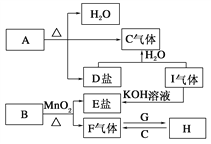
(1)画出G离子结构示意图________;
(2)写出B、I的化学式B________,I________;
(3)写出H的一种用途__________________________________;
(4)写出A受热分解的化学方程式_________________________;
(5)若10g的C6H12O6在氧气中充分燃烧,将产物全部与足量的H充分反应,反应后固体增重____________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】节日燃放的五彩缤纷的烟花与高中化学中“焰色试验”知识相关。下列说法中正确的是( )
A.焰色试验是化学变化
B.用稀盐酸清洗做焰色试验的铂丝(或铁丝)
C.焰色试验均应透过蓝色钴玻璃观察
D.焰色试验可区分NaCl与Na2CO3固体
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 1L1.0mo1L-1的NaAlO2水溶液中含有的氧原子数为2NA
B. 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA
C. Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA
D. 室温下,将9g铝片投入0.5L 18.4molL-1的H2SO4中,转移的电子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】镉(Cd)是一种用途广泛的金属,也是对人体健康威胁最大的有害元素之一。
(1)1.00gCdS固体完全燃烧生成CdO固体和SO2气体放出2.75kJ的热量,该反应的热化学方程式为____。
(2)常温下,Ksp(CdCO3) = 4.0×10-12,Ksp[Cd(OH)2] = 3.2 ×10-14,则溶解度(mol·L-1)较大的是____ [填“CdCO3”或“Cd(OH)2”];若向含112mg·L-1 Cd2+的废水加碱调pH至9.0,达到平衡时,溶液中c(Cd2+)=____。
(3)一种鳌合絮凝剂的制备及其用于去除含镉废水中Cd2+的原理如下:

①聚丙酰胺的单体的结构简式为____。
②使用鳌合絮凝剂处理某含镉废水,镉去除率与pH的关系如图-1所示。在强酸性条件下,pH越小除镉效果越差,其原因是____。

(4)一种用电动力学修复被镉污染的土壤的装置如图-2所示。
①实验前铁粉需依次用NaOH溶液、稀硫酸及蒸馏水洗涤,其目的是____。
②实验过程中铁粉上发生的电极反应为____。
③活性炭的作用是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)下列有关NH3的说法中,不正确的是__________(双选)。
A.工业合成NH3需要在高温高压下进行 B. NH3可用来生产碳铵和尿素等化肥
C. NH3可用浓硫酸或无水氯化钙干燥 D. NH3受热易分解,须置于冷暗处保存
(2)NH3易于水,标准状况下,用充满NH3的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为________________mol.L-1。
(3)氨气在氧化炉中所发生反应的化学方程式为_____________________________________________。
(4)“吸收塔” 尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:Na2CO3+2NO2=NaNO3+________+CO2 (请填写完成化学方程式)。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):属于电解质的是______,属于非电解质_______。
(2)过量②的水溶液与⑦反应的离子方程式______________________。
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①请用单线桥标出电子转移的情况____________;
②浓H2SO4表现出来的性质是:_______;当电子转移0.1mol时,消耗氧化剂的物质的量为_______。
(4)如图表示某同学配制480mL 0.5mol/L 的NaOH溶液的部分操作示意图,其中有错误的是_______,这样操作所配制的溶液比要求的浓度要_________ (填“偏高”、“偏低”、“不影响”)。配制应称取NaOH________g。

查看答案和解析>>
科目: 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂,一些性质及制备方法如下:
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点670℃, 易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为______________。
(2)弯曲的a管所起的作用是_____________________;装置采用较粗的导管来连接装铁粉的硬质玻璃管和广口瓶C,其目的是_____________________________________。
(3)导管b 口应与_______________ (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
(4)实验完成后,取广口瓶C中收集到的产物进行如下测定
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为______%。
(5)由上分析数据和计算得出结论:
①用此装置制得的无水氯化铁含铁_________偏高,偏低),显然其中含有较多________的杂质。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸是常见的弱酸,氨水是常见的弱碱。
(1)25℃时,用0.1000mol·L-1盐酸滴定25.00mL0.1000mol·L-1氨水的滴定曲线如图所示。
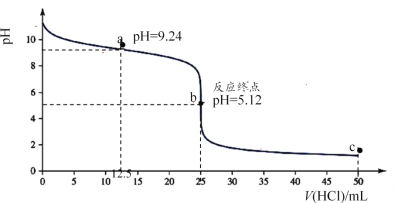
①滴定时,可选用____(填“甲基橙”或“酚酞”)作指示剂; 锥形瓶中水的电离程度:a点____b点(填“>”“<”或“=”)。
②滴定至反应终点前,溶液中发生反应的离子方程式为____。
③滴定至a点处,锥形瓶中NH4+ 、Cl-、NH3·H2O的浓度由小到大的顺序为____。
④滴定至c点处,锥形瓶中NH4+ 、Cl-、H+的浓度由小到大的顺序为____。
(2)25℃时,用HCl或NaOH调节醋酸的pH,配得一组c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1溶液,溶液中H+、OH-、CH3COO-及CH3COOH浓度的对数值(lgc)与pH关系如图所示:
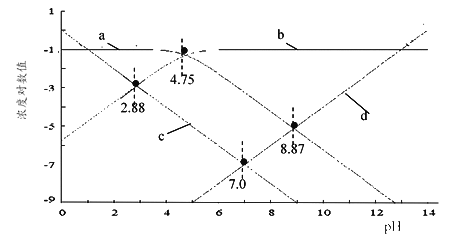
①图中表示H+的线是____(填小写字母);0.1 mol·L-1CH3COONa溶液的pH约为____(保留2位小数)。
②反应CH3COOH![]() CH3COO-+ H+的电离常数的对数值lgK=____(填数值)。
CH3COO-+ H+的电离常数的对数值lgK=____(填数值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com