
科目: 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为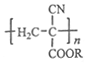 从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A 的化学名称为__________________,。
(2)B的结构简式为____________________。其核磁共振氢谱显示为______组峰,峰面积比为_______。
(3)由C生成D的反应类型为_____________。
(4)由D生成E的化学方程式为__________________________________________________________。
(5)G中的官能团有__________、__________、__________。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有___________种。(不含立体结构)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要配制0.50 mol·L-1NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________g。
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:

②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是_________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_____________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。
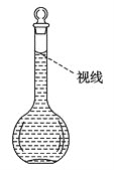
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习化学的重要工具。如图是元素周期表中的一格,从中获取的信息不正确的是( )

A. 该元素的元素符号为Te
B. 该元素属于金属元素
C. 该元素的原子核外有52个电子
D. 该元素的相对原子质量为127.6
查看答案和解析>>
科目: 来源: 题型:
【题目】溴化亚铁是聚合反应中常用的一种催化剂,易潮解变质,800℃以上可升华,高温时FeBr3 会快速分解为FeBr2。某校同学设计实验用干燥的HBr 与Fe 反应制备少量FeBr2,实验装置如下(部分夹持装置已省略),请回答相关问题:
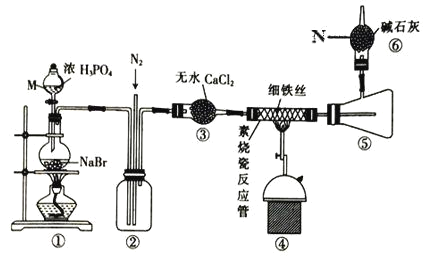
(1)仪器 M 名称是___,装置④中主要的化学方程式为__________。
(2)装置⑥的作用是___,逸出的气体主要是_____(填化学式)。
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是____。
(4)将浓磷酸换成浓硫酸同样能制得 HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制 HBr 的原因是硫酸和磷酸都具有___(填选项字母)。
a.脱水性 b.强氧化性 c.难挥发性
②溶液变橙黄色是因为发生了副反应____(写化学方程式)。
③浓磷酸换成浓硫酸对产品纯度____ (填“有”或“没有”)影响,理由是__
查看答案和解析>>
科目: 来源: 题型:
【题目】无水FeCl3呈棕红色,极易潮解, 100 ℃ 左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
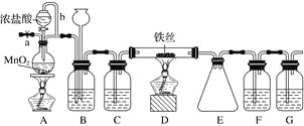
(1)装置A中反应的离子方程式为____________________________________________。
(2)装置F中所加的试剂为________。
(3)导管b的作用为________________________________________________________;
装置B的作用为__________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为__________。
(5)反应结束后,拆卸装置前,必须进行的操作是______________________。
(6)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入
________________________(填试剂名称和现象)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 A、B、D、H 是中学化学中常见的单质,其中 A、D 为气体,J 为蓝色溶液。转化关系如下(部分生成物及反应条件已略去):
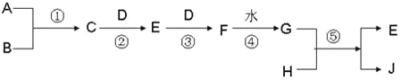
(1)若 B 为气体时,当用玻璃棒分别蘸取 C、G 的浓溶液并使它们靠近时,有白烟生成。则
①请写出下列物质的化学式C__________,F______________。
②在溶液中,检验白烟中阳离子的方法__________________。
(2)若B为固体时,已知 E 是一种常见的空气污染物,且将 C 与 E 混合可生成淡黄色固体 B,写出 G 与 H 反应的化学方程式_____,简述检验气体E的方法_____。
(3)若G 分别是HNO3 和H2SO4,取两者的混合溶液 10 mL,加入0.25molL﹣1Ba(OH)2 溶液时,生成沉淀的质量 w(g)和 Ba(OH)2 溶液的体积 V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中 H2SO4 的物质的量浓度为_________mol·L-1,HNO3 的物质的量浓度为_____________mol·L-1。

查看答案和解析>>
科目: 来源: 题型:
【题目】某氯化铁与氯化亚铁的混合物,现要测定其中铁元素的质量分数,实验按以下步骤进行:
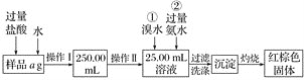
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式:_______________________________________。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3 g,则接下来还应进行的操作是______________________________。若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
Ⅱ.有同学提出,还可以采用以下方法来测定:
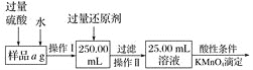
(4)溶解样品改用了硫酸,而不再用盐酸,为什么? ______________________________。
(5)选择的还原剂是否能用铁________(填“是”或“否”),原因是:___________________。
(6)若滴定用掉cmol·L-1KMnO4溶液bmL,则样品中铁元素的质量分数是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________________________。
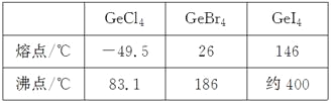
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为________。
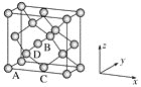
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】建筑工地常用的 NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2 能发生如下反应:NaNO2+HI→NO+I2+NaI+H2O。
(1)配平上述反应方程式___________;
(2)上述反应中有 0.3 mol 电子转移,则生成 NO 在标准状况下的体积是_______L。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别 NaNO2 和 NaCl 固体,结合后面提供的物质进行实验,下列能实现实验目的的物质组合是___(填序号)。
①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋
(4)某厂废切削液中,含有2%~5%的NaNO2,直接排放会造成污染,采用 NH4Cl,能使 NaNO2 转化为不引起二次污染的 N2,反应的化学方程式为______;若处理含 5%的 NaNO2废液 10t,理论上需要加入 NH4Cl____t(保留 3 位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com