
科目: 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列各题:
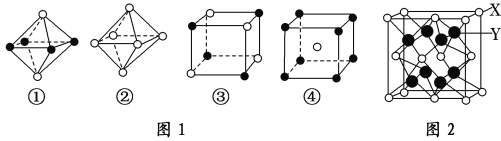
(1)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为___________。P形成的三种酸的酸性由强到弱的顺序为:HPO3>H3PO4>H3PO3,原因是___________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,T的基态原子价电子排布式为___________________,Q2+的未成对电子数是______________。
(3)如图1是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图是图1中的______________。
(4)[Cu(NH3)4]2+配离子中存在的化学键类型有_____________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为______________(填序号)
①平面正方形 ②正四面体 ③三角锥形 ④V形
(6)X与Y可形成离子化合物,其晶胞结构如图2所示,其中X和Y的相对原子质量分别为a和b,NA表示阿伏加德罗常数,晶体密度为ρg/cm3,则晶胞中距离最近的X、Y之间的核间距离是_____________pm(用含ρ、a、b、NA的代数式表达)。
查看答案和解析>>
科目: 来源: 题型:
【题目】对反应A(s)+ 3B(g)![]() 2C(g)+ D(g)来说,下列反应速率最快的是
2C(g)+ D(g)来说,下列反应速率最快的是
A. v(A)=0.3 mol/(Ls) B. v(B)=0.6 mol/(Lmin)
C. v(C)=0.5 mol/(Lmin) D. v(D)=0.01 mol/(Ls)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为发光二极管连接柠檬电池装置,下列说法正确的是
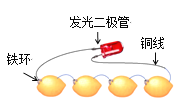
A. 铁环作为柠檬电池的正极
B. 电子由发光二极管经导线流向Fe环
C. 负极的电极反应为:Fe-2 e-===Fe2+
D. 可将柠檬替换成盛装酒精溶液的装置
查看答案和解析>>
科目: 来源: 题型:
【题目】浓硫酸与金属的反应是我们一直探讨和研究的重要课题之一。
Ⅰ.铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4![]() cCu2S+dCuSO4+eH2O。则a:b=______.
cCu2S+dCuSO4+eH2O。则a:b=______.
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
(探究一)(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是________;
(2)铁与浓硫酸在加热时的化学方程式为:______________;
(3)称取碳素钢6.0g放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用____________;
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生反应后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为_______;
(探究二)根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体在标准状况下密度为0.0893g/L。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
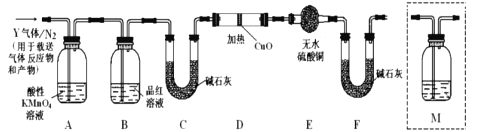
(4)装置B中试剂的作用是__________;
(5)分析Y气体中的![]() 气体是如何生成的___________(用化学方程式表示):
气体是如何生成的___________(用化学方程式表示):
(6)为确认![]() 的存在,需在装置中添加洗气瓶M于___________;
的存在,需在装置中添加洗气瓶M于___________;
a.A之前 b.A-B间 c.B-C间 d.C-D间
(7)如果气体Y中含有![]() ,预计实验现象应是_________________。
,预计实验现象应是_________________。
Ⅲ.将一定质量的Zn与100mL一定浓度的H2SO4充分反应:
(1)若反应前c(H2SO4)=12.0mol/L,反应后称量剩余锌发现质量减少了65.0g。将反应后的溶液稀释至1L,此时溶液中c(SO42-)=______mo/L,产生SO2体积(标准状况下)V(SO2)=______L;
(2)将(1)中产生的气体缓缓通入100mL a mo/L NaOH溶液中,SO2和NaOH都完全消耗,则a的取值范围为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列框图中的物质均为中学化学常见物质。已知A、B、C均为有刺激性气味的气体,A、B分别通入品红溶液中,红色均褪去:B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体。反应①需要有水参加:反应②有大量白烟生成。
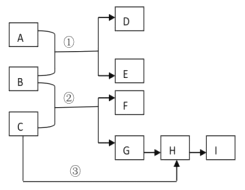
请回答下列问题:
(1)写出下列物质的化学式:B______,C_______,F_______,I_______。
(2)写出反应①的离子方程式____________________。
(3)写出下列变化的化学方程式:
反应②________________________。
反应③_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列各题:
(1)CH![]() 、—CH3、CH
、—CH3、CH![]() 都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH
都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH![]() 的键角应是________。
的键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N![]() 叫作叠氮离子,请写出由三个原子构成的含有与N
叫作叠氮离子,请写出由三个原子构成的含有与N![]() 的电子数相同的分子的结构式_______________、______________。
的电子数相同的分子的结构式_______________、______________。
(3)SiO![]() 、SO3、NO
、SO3、NO![]() 三种粒子是等电子体,它们的立体构型为____________,其中SiO44-、PO43-、SO42-的立体构型为_____________。
三种粒子是等电子体,它们的立体构型为____________,其中SiO44-、PO43-、SO42-的立体构型为_____________。
(4)C2O42-和________是等电子体,C2O42-具有较强的还原性,能使酸性KMnO4溶液褪色,写出反应的离子方程式__________________________________________。
(5)2原子14电子的等电子体的共同特点是粒子中都具有共价三键,请举出相应的3个例子______________、______________、______________(分子或离子)。每个分子或离子均含有_________个σ键,________个π键。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼及其化合物在现代工业、生活和国防中有着重要的应用价值。
(1)最简单的硼烷是B2H6(乙硼烷),结构如图所示,其中B原子的杂化方式为________。
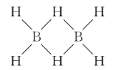
(2)三氯化硼和三氟化硼常温下都是气体,都有强烈的接受孤电子对的倾向。推测它们固态时的晶体类型为________;三氟化硼与氨气相遇,立即生成白色固体,写出该白色固体结构式,并标注出其中的配位键________。
(3)经结构研究证明,硼酸晶体中B(OH)3单元结构如图Ⅰ所示。各单元中的氧原子通过O—H…O氢键连结成层状结构,其片层结构及键长、层间距数据如图Ⅱ所示。层与层之间以微弱的分子间力相结合构成整个硼酸晶体。

①H3BO3是一元弱酸,写出它在水中的电离方程式(与氨类似)_____________________;
②根据结构判断下列说法正确的是________;
a.硼酸晶体有滑腻感,可作润滑剂
b.H3BO3分子的稳定性与氢键有关
c.含1 mol H3BO3的晶体中有3 mol氢键
d.H3BO3分子中硼原子最外层为8e-稳定结构
(4)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图为其晶胞结构示意图。
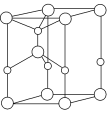
①该功能陶瓷的化学式为________________;
②第一电离能介于B、N之间的第二周期元素有________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A. 硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B. 硅的导电性能介于导体和绝缘体之间,是良好的半导体材料
C. 硅的化学性质不活泼,常温下不与任何物质起反应
D. 当加热到一定温度时,硅能与氯气、氢气等非金属反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氯,硫,氯元素广泛存在于自然界中,对人类生命和生活具有重要意义。
(1)氯气的颜色:______;![]() 在
在![]() 中燃烧火焰颜色:__________。
中燃烧火焰颜色:__________。
(2)浓硫酸具有:①酸性②强氧化性③吸水性④脱水性,下列现象硫酸所表现出的性质为(填编号)
干燥氯气______,使蔗糖变黑________,吸收氨气_________,与铜反应________。
(3)为了提高农作物的产量,德国化学家哈伯、波施等成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式表示工业合成氨的反应原理:________;实验室制取氨气的化学方程式____________。
(4)自然界形成NO的化学方程式:_____________。氮氧化物(![]() )污染环境,若用
)污染环境,若用![]() ,溶液吸收
,溶液吸收![]() 可生成
可生成![]() ,9.2g
,9.2g![]() 和
和![]() 溶夜完全反应时转移电子0.1mol,则反应的离子方程式为_____________。
溶夜完全反应时转移电子0.1mol,则反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com