
科目: 来源: 题型:
【题目】设NA为阿伏加徳罗常数的数値,下列说法正确的是( )
A. 常温常圧下,7.0g由丁烯与丙烯組成的混合气体中含有的氢原子数目为NA
B. 向1L的密闭容器中充入46gNO2气体,容器中气体的分子数为NA
C. 6.4g铜与足量的硫单质混合加热,转移电子的数目为0.2NA
D. 标准状况下,2.24LSO3中含有0.1NA个SO3分子
查看答案和解析>>
科目: 来源: 题型:
【题目】用![]() 高能原子轰击
高能原子轰击![]() 的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
A. 112号元素的相对原子质量为277
B. 此变化不属于化学变化
C. 科学家合成的112号元素是金属元素
D. 112号元素位于第七周期第ⅡB族
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列溶液中各组离子一定能大量共存的是( )
A. 使甲基橙呈红色的溶液中:Na+、AlO2-、NO3—、Fe2+
B. 0.1 molL-1HCl溶液:Ba2+、K+、CH3COO-、NO3—
C. 0.1 molL-1 CO32-的溶液:Na+、Fe3+、NO![]() 、SCN-
、SCN-
D. Kw/c(H+)=0.1 molL-1的溶液:Na+、K+、SO32-、NO3—
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
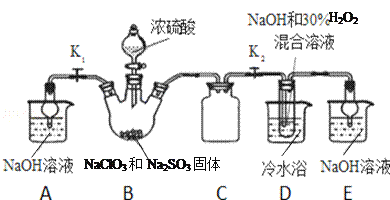
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是_____________;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________;装置D中反应生成NaClO2的化学方程式为___________________;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是_________________;检验该离子的方法是______________________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______________;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以硫化铜精矿为原料生产CuCl的工艺过程如下:
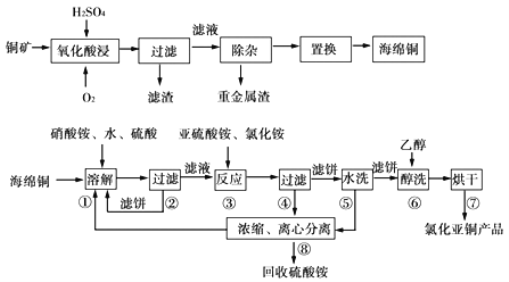
已知CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化,海绵铜中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式_____________
(2)步骤①中得到的氧化产物是____________,溶解温度应控制在60—70℃,原因是_____________。
(3)写出步骤③中主要反应的离子方程式_____________。
(4)步骤③先加NH4Cl、再加入亚硫酸铵时无沉淀,加水稀释就产生大量臼色沉淀,其原因_____________。
(5)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________(写名称)。
(6)上述工艺中,步骤⑥不能省略,理由是_____________。
(7)上述浓缩液中含有Iˉ、CIˉ等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中中![]() 为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
查看答案和解析>>
科目: 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为____________________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___________________。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______(用a表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 合成氨工业使用催化剂,可提高氨的日产量
B. 合成氨工业通常采用高压,以提高原料的利用率
C. 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 氯气在饱和食盐水中的溶解度比在水中的小
查看答案和解析>>
科目: 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
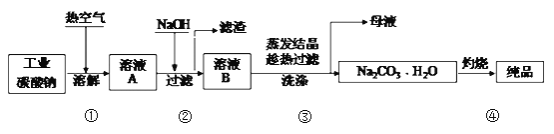
下列说法不正确的是
A. 步骤①,通入热空气可加快溶解速率
B. 步骤②,产生滤渣的离子反应为:Mg2+ + Fe3+ + 5OH- == Mg(OH)2↓+ Fe(OH)3↓
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3H2O中混有Na2CO310H2O等杂质
D. 步骤④,灼烧时用到的主要仪器有铁坩埚、泥三角、三脚架、酒精灯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com