
科目: 来源: 题型:
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为____________,基态镍原子中核外电子占据最高能层的符号为_____________.
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子__________________________________________________________(任写一种).
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式)______,理由是_______________________________________________________________.
(4)H2S的键角__________(填“大于”“小于””等于”)H2O的键角,请从电负性的角度说明理由___________________________________________________.
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为_________g/cm3(只列出计算式).

查看答案和解析>>
科目: 来源: 题型:
【题目】下面是几种常见的化学电源示意图,有关说法不正确的是

A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池在长时间使用后,锌筒被破坏
C. 铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
D. 氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持、加热仪器已略去,气密性已检验)。
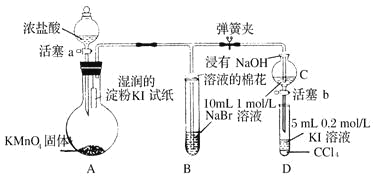
实验过程;
I.打开弹簧夹,打开活塞a,清加浓盐酸。II.当 B 和C 中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。Ⅳ……
(1)A中产生的是黄绿色气体,其离子方程式为____________,在该反应中浓盐酸表现了___________性。
(2)验证氯气的氧化性强于碘的实验现象是___________________________。
(3)B 中溶液发生反应的离子方程式是__________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________。
(5)过程Ⅲ实验的目的是__________________________。
(6)从元素周期表的递变规律的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】W.X.Y.Z.Q五种元素的原子序数依次增大。其中X原子的价电子构型为nsnnpn,Y原子的L电子层中,有三个未成对的电子,且无空轨道;W.Z的原子序数相差18,且Z原子的第一电离能在同周期中最低,Q+中所有电子正好充满K.L.M三个电子层,请回答下列问题:
(1)写出Y3-离子的电子排布式________。
(2)Y.Z.Q电负性由小到大的顺序是________。(填元素符号)
(3)已知Y的氢化物能与Q2+形成配离子[Q(YH3)4]2+,该配离子中存在的化学键有________。(填标号)
A.氢键 B离子键 C.共价键 D.配位键
(4)Q与某非金属原子A形成的晶体结构如图所示。该晶体的化学式是________,与同一个A微粒距离最近的Q微粒有________个。

查看答案和解析>>
科目: 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
i.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g)△H1
H2S(g)+CO2(g)△H1
ⅱ.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知反应中相关的化学键键能数据如下表:
化学键 | H-H | C=O(COS) | C=S | H-S | C |
E/kJ·mol-1 | 436 | 745 | 580 | 339 | 1076 |
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(a)与温度(T)的关系如图(a)所示。则A、B、C三点对应的化学反应速率大小顺序为_________(填标号)。

②结合上表中数据,计算反应ⅱ的△H2为___________。
③反应ⅱ的正、逆反应的平衡常数(K)与温度(T)的关系如上图(b)所示,其中表示逆反应的平衡常数(K)的曲线是_______________(填“A”或“B”)。T1℃时,向容积为2L的恒容密闭容器中充入2 mol COS(g)和1molH2(g),发生反应ⅱ,COS的平衡转化率为__________________。
(2)过二硫酸是一种强氧化性酸,其结构式如下所示,
 ,在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为______。
,在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为______。
(3)NaHS可用于污水处理的沉淀剂。
已知:25℃时,反应Hg2+(aq)+HS-(aq)![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。则Ksp(HgS)=__________。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。则Ksp(HgS)=__________。
(4)降低SO2的排放量已经写入2018年政府工作报告,某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2,还可以制得H2SO4。在阴极放电的物质是_____________,在阳极生成SO3的电极反应式是__________________。
 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎.硼.镓.硒等。回答下列问題:
(1)硒的基态原子的电子排布式为________。已知铜和某元素M的电负性分别是1.9和3.0,则铜与M形成的化合物属于________填“离子”,“共价”)化合物。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释________________。
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是________。
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3.在BF3·NH3中B原子的杂化方式为________,B与N之间形成配位键,氮原子提供________。写出一种与NH3互为等电子体的离子的化学式______________。
(4)含硼化合物是一种常见的还原剂,结构如图所示。请在图中画出配位键________。

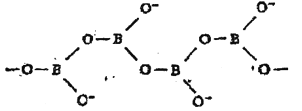
(5)多硼酸根离子可以通过三角形共用原子连接成链状,片状或者三维网状多硼酸根离子。下图是无限长单链结构的多硼酸根离子,其中与原子数之比为 ,化学式为________________
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家在-100 ℃的低温下合成了一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法不正确的是
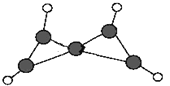
A. X不能使酸性KMnO4溶液褪色
B. X的性质与烯烃类似,容易发生加成反应
C. X在常温下不能稳定存在
D. 充分燃烧等质量的X和甲烷,X消耗氧气比甲烷少
查看答案和解析>>
科目: 来源: 题型:
【题目】利用某工业废铁粉(主要成分为Fe2O3.Fe等)与硫酸反应可制备硫酸亚铁。
(1)Fe元素在周期表中的位置是________写出该废铁粉与硫酸主要反应的离子方程式________________。
(2)FeSO4隔绝空气受热分解生成SO2 SO3 Fe2O3。SO2分子的空间构型为________,其中S原子的杂化轨道类型为________。与SO2互为等电子体的离子与分子分别为________,________(填化学式)
(3)苯酚溶液中滴入Fe3+离子,溶液显________色。1mol苯酚中含有σ键的数目为________。
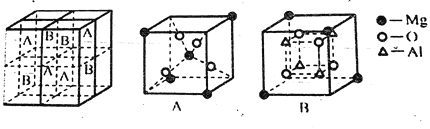
(4)Fe3O4有反尖晶石结构。某化合物MgxAlyOz与反尖晶石结构相仿,其结构如下图所示,它是由下列A.B方块组成。该化合物的化学式为________.
(5)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为________,如果铁的原子半径为0.12nm,阿伏伽德罗常数的值为NA,则此种铁单质的密度表达式为________g/cm3

查看答案和解析>>
科目: 来源: 题型:
【题目】有关晶体的下列说法中不正确的是( )
A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在NaCl晶体中,每个晶胞平均占有4个Na+
C. 金属导电是因为在外加电场作用下产生自由电子
D. 铜晶体为面心立方堆积,铜原子的配位数(距离一个铜原子最近的其他铜原子的个数)为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com