
科目: 来源: 题型:
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:

已知:①Cr2O72-+H2O![]() 2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)碱溶的目的是__________,所加40%NaOH不宜过量太多的原因是______________________。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_____________。
(3)使用下列用品来测定溶液的pH,合理的是_____(填字母)。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。

①图中仪器A的名称为_______。
②在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:___________。
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体_____,____,冷却结晶,过滤,____,低温干燥,得到CrCl3·6H2O。(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式,书写正确的是()
A. H2SO4=2H++SO42- B. NH3·H2O=NH4++OH-
C. H2CO3=H2O+CO2↑ D. H2CO3![]() 2H++CO32-
2H++CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖
其中属于电解质的是___________ ,属于强电解质的是_____________。能导电的是___________。
Ⅱ.胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入___________溶液,继续煮沸至____________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为______________________________________________。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做_______________。
③区分胶体和溶液常用的方法叫做__________。
Ⅲ.①FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为_________________________。
②有学生利用FeCl3溶液制取FeCl36H2O晶体主要操作包括:滴入过量盐酸,______、冷却结晶、过滤。过滤操作除了漏斗、烧杯还需要什么玻璃仪器________________。
③高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
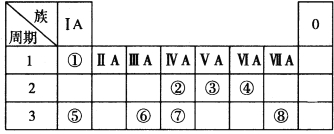
(1)地壳中含量居于第二位的元素在周期表中的位置是____。
(2)②的最高价氧化物的分子式为_____;⑦的最高价氧化物对应水化物的分子式为__。
(3)①、④、⑤三种元素可形成既含离子键又含共价键的离子化合物,该化合物的电子式为_____。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___(填字母,双选)。
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 任何化学反应不一定都有反应热
B. 使用催化剂可以改变反应的平衡常数
C. 升高温度使反应加快,是因为降低了反应的活化能
D. 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为
(2x)Al2(SO4)3+3xCaCO3+3xH2O![]() 2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
(1)制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有___________________。
(2)碱式硫酸铝溶液吸收SO2过程中,溶液的pH___________(填“增大”、“减小”、“不变”)。
(3)通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在化学研究领域,经常需要对一些物质进行性质的确定。如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
①准确称量m g金属镁(已除去表面氧化膜),用铜网包住放入干净的试管中;
②按图示组装好装置,然后在关闭活塞的分液漏斗中装入一定体积2 mol/L的盐酸;
③调整右边玻璃管(带均匀刻度值),让U型管(下端黑色部分是橡胶管)两端液面在同一水平面,读出右边玻璃管的液面刻度值为V1mL ;
④打开分液漏斗活塞,让一定量的盐酸进入试管中后立即关闭活塞;
⑤当镁条反应完后, ,读出右边玻璃管的液面刻 度为V2 mL。

请回答下列问题:
(1)写出你认为步骤⑤中空格应进行的操作_______________________________。
(2)若V1,V2均是折算为标况下的值,则镁的相对原子质量Ar(Mg)的实验测定表达式为Ar(Mg)=_______________,你认为此表达式求出的值是否准确?__________________(填‘是’或‘不’),主要问题为__________________________________(若回答‘是’则此空不填)。
(3)步骤①中,为什么要用铜网包住镁条?________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com