
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.棉花和蚕丝的主要成分都是纤维素
B.蛋白质在一定条件发生水解反应生成葡萄糖
C.酶是一类具有催化作用的蛋白质,其催化作用有很强的专一性、高效性
D.食用植物油的主要成分是不饱和高级脂肪酸甘油酯,属于高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语表示不正确的是( )
A. 氮化镁:MgN
B. Ca(OH)2的电离方程式:Ca(OH)2=Ca2++2OH
C. 中子数为18的氯原子:![]()
D. 氟化钠的电子式为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知元素X位于Y的下一周期,X、Y的原子序数均不大于20.某含氧酸盐甲的化学式 为XYO3。请回答:
(1)常温下X的单质能与水发生反应,395℃时,甲能发生分解反应生成两种盐,一种是 含Y元素的无氧酸盐,则X位于周期表_____,甲发生分解反应的化学方程式是_____。
(2) 若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体.
①则甲为_____(填化学式)该气体能使酸性高锰酸钾溶液褪色, 该反应的离子方程式为_____;
②X、Y形成简单离子半径大小关系为 > (用离子符号表示)._________
③25℃时,甲在水中的沉淀溶解平衡曲线如右图所示,若要使溶液 X2+离子沉淀完全,则 YO32-离子的最小浓度为_____mol·L-1。
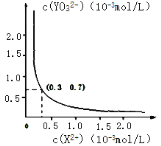
(当离子浓度小于 1×10-5mol·L-1 时,该离子沉淀完全)
(3)若甲能与盐酸反应,生成无色、无味的气体乙.则:
①乙的电子式为_____;
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】3.2g铜与过量硝酸(8molL -1,30mL)充分反应,硝酸的还原产物为NO2 和NO,反应后溶液中含amolH+ ,则此时溶液中所含NO3—为( ) mol
A. 0.2+a B. 0.1+a C. 0.05+a D. a
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,____与盐酸反应最慢。
Ⅱ. 利用如图装置可以验证非金属性的变化规律。
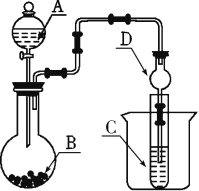
(2)仪器A的名称为_______,干燥管D的作用是_____。
(3)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为___、___、.____,装置C中的实验现象为有黄色沉淀生成,离子方程式为__________________。
(4)若要证明非金属性:S>C>Si,则A中加____,B中加Na2CO3,C中加_____,观察到C中溶液的现象为_____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾 病的药物。以2氯苯甲醛为原料合成该药物的路线如下:

(1)A中官能团名称为_____,A发生银镜反应的化学方程式为_____。
(2)C生成D的反应类型为_____。
(3)X(C6H7BrS)的结构简式为_____。
(4)写出C聚合成高分子化合物的化学反应方程式:_____。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有______种。
①除苯环之外无其他环状结构;②能发生银镜反应。 其中核磁共振氢谱中有5个吸收峰,且峰值比为2∶2∶1∶1∶1的结构简式为_____。
(6)已知: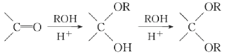 ,写出以乙烯、甲醇为有机原料制备化 合物
,写出以乙烯、甲醇为有机原料制备化 合物![]() 的合成路线(无机试剂任选)__________
的合成路线(无机试剂任选)__________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质性质或反应在生活中的应用错误的是
A. 合金具有优良性能,可用于制造新型金属材料
B. 氧化铁俗称铁红,可用作红色油漆和外墙涂料
C. 二氧化硫具有漂白性,常用来漂白食品
D. HF与SiO2的反应可用作在玻璃器皿上刻蚀标记
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍。C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式)______,E、F、L所形成的简单离子的半径由小到大的顺序为(用离子符号表示)_____。
(2)由L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为____。
(3)少量固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有淡黄色沉淀产生,并无气泡冒出,请结合信息写出该反应的离子方程式 _____________________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为_______
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为原电池装置示意图:

(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A电极名称为_______,写出正极电极反应式:___________。
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则铜片为____极(填“正”或“负”),写出电极反应式:正极 ______________________,负极 _________________________。
(3)若A.B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的____极(填“正”或“负”),该电池的总反应为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在水溶液中,下列电离方程式正确的是
A.Al2(SO4)3=2Al3++3SO42-
B.AlCl3=Al3++Cl3-
C.Mg(NO3)2=Mg+2+2NO3-
D.KMnO4=K++Mn7++4O2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com