
科目: 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr-2e-==NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-== Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40g Na2S4
查看答案和解析>>
科目: 来源: 题型:
【题目】为了防止食品受潮及富脂食品氧化变质,在包装袋中应放入的独立包装的物质是
A. 无水硫酸铜、蔗糖 B. 食盐、硫酸亚铁
C. 生石灰、还原铁粉 D. 生石灰、食盐
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用一氧化碳和氢气反应生甲醇。一定条件下,在体积为VL的密闭容器中,CO(g)+2H2(g) ![]() CH3OH(g),下图表示该反应在不同温度下的反应过程。关于该反应,下列说法正确的是
CH3OH(g),下图表示该反应在不同温度下的反应过程。关于该反应,下列说法正确的是

A. 反应达平衡后,升高温度,平衡常数K增大
B. 工业生产中温度越低,越有利于甲醇的合成
C. 500℃反应达到平衡时,该反应的反应速率是v(H2)= ![]() mol/(L·min)
mol/(L·min)
D. 300℃反应达到平衡后,若其他条件不变,将容器体积扩大为2VL,c(H2)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:_______
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。

①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至____后,迅速关闭K1,观察到U形管内的现象是______。
②装置Ⅲ中发生反应的化学方程式为__________。
③蘸NaOH溶液的棉花团的作用是____________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO______。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是


A. 图1表示常温下向体积为10 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计了如下装置用于制取SO2和验证SO2的性质。
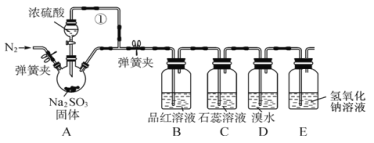
试回答以下问题:
(1)装置A 中用于添加浓硫酸的仪器名称为____,其中反应的化学方程式为________。
(2)导管①的作用是________。
(3)装置D中可观察到的现象是_______,体现出 SO2 ______性。
(4)E装置的作用是_______,发生反应的离子方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在甲、乙、丙三个体积相等且恒容的密闭容器中发生反应:NO2(g)+SO2(g) ![]() SO3(g)+NO(g)。投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+NO(g)。投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/(mol·L-1) | 0.10 | 0.20 | 0.20 |
c(SO2)/(mol·L-1) | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2min的平均速率v(NO)=0.05mol·L-1·min-1
B. 容器乙中若起始时改充0.10mol·L-1NO2和0.20mol·L-1SO2,达到平时c(NO)与原平衡相同
C. 达到平衡时,容器丙中SO3的体积分数是容器甲中SO3的体积分数的2倍
D. 达到平衡时,容器乙中NO2的转化率和容器丙中NO2的转化率相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质的用途,叙述不正确的是
A.二氧化硫可广泛用于食品的增白B.Na2SiO3常用作制木材防火剂
C.硅胶可用作食品干燥剂D.硅可用于制作硅芯片和光电池
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示(已知:p![]() = –lg
= –lg![]() )。下列叙述不正确的是
)。下列叙述不正确的是

A. Ka(HA)为10-4.76
B. 滴加NaOH溶液过程中,![]() 不变
不变
C. m点所示溶液中:c(H+)=c(HA)+c(OH-)c(Na+)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com