
科目: 来源: 题型:
【题目】下列溶液中导电性最强的是
A. 1L0.1mol/L醋酸B. 0.1L 0.1mol/L H2SO4溶液
C. 0.5L 0.1mol/L盐酸D. 2L 0.1mol/L H2SO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】合金是建造航空母舰的主体材料.
(1)航母升降机可由铝合金制造.
①铝元素在周期表中的位置为 ____________.
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为_________________.
(2)AlCl3也是重要的铝盐,无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备.
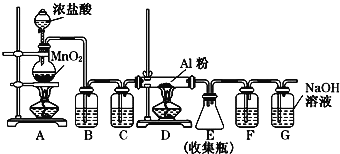
①装置A中发生反应的离子方程式为_____________________________________.
②装置B、C中盛放的试剂是B:__________ ,C:__________.
③装置G的作用是__________.
④无水AlCl3遇潮湿空气产生大量白雾的成分是__________.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质均为Wg,将它们在氧气中完全燃烧的产物全部通入到过量的过氧化钠固体中,则过氧化钠固体增重为大于Wg的是()
①CH3CH2OH②HOOCCOOH③CH4④HCHO⑤CH3COOH⑥HCOOH
A. ④⑤ B. ②⑥ C. ①③ D. ①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃和1.01×105时,2N2O5(g)=4NO2(g)+O2(g) △H =+56.76kJ/mol ,该反应能自发进行的原因是
A.是吸热反应B.是放热反应
C.是熵减少的反应D.熵增大效应大于焓效应
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5).其制备工艺流程如下:
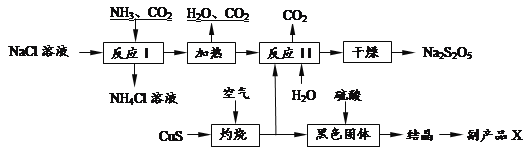
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应.
(1)反应I的化学方程式为:_____________________________________________________ .
(2)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:__________________________.
(3)反应I时应先通的气体为______,副产品X的化学式是______.
(4)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为______.检验产品中含有碳酸钠杂质所需试剂是______(填编号)
①酸性高锰酸钾②品红溶液③澄清石灰水
④饱和碳酸氢钠溶液⑤NaOH⑥稀硫酸.
查看答案和解析>>
科目: 来源: 题型:
【题目】化学学习和研究离不开元素周期表。表为元素周期表的一部分,表中①-⑩分别代表一种元素。回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
3 | ⑧ | ⑨ | ⑩ |
(1)上述元素中,有一种元素在自然界中形成的物质种类最多,该元素在周期表中的位置是______。
(2)⑧、⑨、⑩元素的离子半径由大到小的顺序为______(用离子符号表示)。
(3)写出由①、⑥、⑧三种元素形成的一种离子化合物的电子式___________。
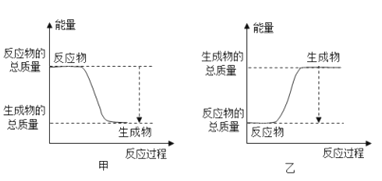
(4)上述元素中有一种元素的氧化物和氢氧化物都有两性,画出该元素的原子结构示意图______;高温条件下,该元素的单质与铁红能发生反应,此反应常用于野外焊接钢轨,则该反应的能量变化可用图______表示。![]() 填“甲“或“乙”
填“甲“或“乙”![]()
从①-⑩中任选元素,按下面要求写出一个置换反应:_____________________。要求:非金属单质1 + 化合物1→非金属单质2 + 化合物2
查看答案和解析>>
科目: 来源: 题型:
【题目】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是

A. a点对应的沉淀只有BaSO4
B. b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-==Al(OH)3↓+2BaSO4↓
C. c点溶液呈碱性
D. c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
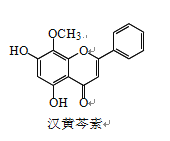
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作或装置能达到实验目的是( )
A.  验证NaHCO3和Na2CO3的热稳定性 B.
验证NaHCO3和Na2CO3的热稳定性 B.  分离Fe(OH)3胶体
分离Fe(OH)3胶体
C.  称取一定量的NaOH D.
称取一定量的NaOH D.  制取NaHCO3
制取NaHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年1月9日,中国中医科学院青嵩家专家屠呦呦研究员获得2016年度国家科学技术奖最高奖。青蒿素为烃的含氧衍生物,无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。某学习小组模拟从青嵩中提取青嵩素,并设计实验测定青嵩素的分子结构。
(1)青嵩素的提取
从青嵩中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

已知:乙醚沸点为35℃。
①操作I的名称为______。
②操作III的主要过程可能是_____________。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(2)青蒿素分子式的测定
可用燃烧法测定青蒿素的实验式,所需装置如下:
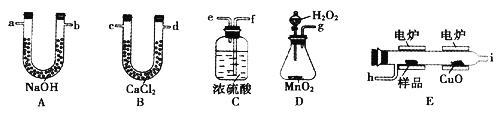
①产生的氧气按以左到右流向,所选装置各导管的连接顺序是g→c→_______→盛有碱石灰的干燥管(装置不能重复使用)。
②B装置的作用是______。
③E装置中CuO的作用是_______。
④称取28.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A装置质量增加66g,C装置质量增加19.8g,则该有机物的最简式为_______。
⑤若把盛有碱石灰的干燥管的装置去掉,所测得样品中氧的质量分数会_____(填“偏大”。“偏小”或“不变”)。
⑥要确定该有机物的分子式,还需要调定的物理量为_______。
⑦将青蒿素加入滴有酚酞NaOH溶液中,溶被颜色无明显变化,加热并搅拌,溶液红色变浅,说明青蒿素可能与_____(填字母)具有相同的性质。
A.乙醇 B.苯酚 C.丙酸 D.油脂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com