
科目: 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__________min(填0~1、1~2、2~3、3~4、4~5),原因是__________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率__________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是(_________)
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
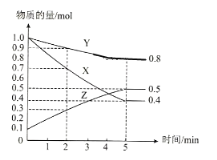
①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是__________。
A X、Y、Z的反应速率相等
B X、Y的反应速率比为3:1
C 容器内气体压强保持不变
D 生成1mol Y的同时生成2mol Z
③2min内X的转化率为__________。
④若上述反应中X、Y、Z分别为H2、N2、NH3,且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向体积为2L的密闭容器中通入NO2 (气体)和N2O4 (无色气体),二者之间可相互转化,反应过程中各物质的物质的量随时间的变化曲线如图所示。回答下列问题:

(1)0~3min内用N2O4表示的平均反应速率为___________。
(2)若升高温度,则v(正)__________(填“加快”“减慢”或“不变”,下同),v(逆)___________。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得:甲中v(NO2)=0.2mol·L-1·s-1,乙中v(N2O4)=9mol·L-1·min-1,则_________(填“甲”或“乙”)中反应更快。
(4)下列叙述能说明该反应已达到化学平衡状态的是(_____)
A v(NO2)=2 v(N2O4)
B 容器内压强不再发生变化
C X的体积分数不再发生变化
D 容器内气体的原子总数不再发生变化
E 相同时间内消耗n mol Y的同时生成2n mol X
F 相同时间内消耗n mol Y的同时消耗2n mol X
查看答案和解析>>
科目: 来源: 题型:
【题目】钼是一种重要的过渡金属元素,通常用作合金及不锈钢的添加剂,可增强合金的强度、硬度、可焊性等。钼酸钠晶体(Na2MoO4·2H2O)可作为无公害型冷却水系统的金属腐蚀抑制剂,如图15是化工生产中以辉钼矿(主要成分为硫化钼MoS2)为原料来制备金属钼、钼酸钠晶体的主要流程图。
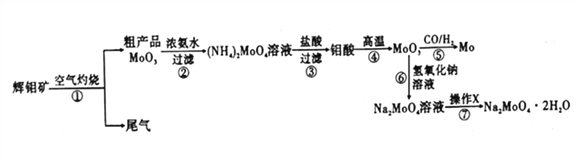
回答下列问题:
(1)已知反应③为复分解反应,则钼酸中钥的化合价为___________。
(2)反应⑥的离子方程式为___________。
(3)辉钼矿灼烧时的化学方程式为____________。
(4)操作X为_________。已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X中应控制温度的最佳范围为_______(填序号)。
温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 | ||||||
溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0℃~10℃ B.10℃~100℃ C.15.5℃~50℃ D.100℃以上
(5)制备钼酸钠晶体还可用通过向精制的辉钼矿中直接加入次氯酸钠溶液氧化的方法,若氧化过程中,还有硫酸钠生成,则氧化剂与还原剂的物质的量之比为_________。
(6)Li、MoS2可充电电池的工作原理为xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
(7)可用还原性气体(CO和H2)还原MoO3制钼,业上制备还原性气体CO和H2的反应原理之一为CO2+CH4![]() 2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2还原MoO3制钼,理论上能生产钼的质量为_________。
2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2还原MoO3制钼,理论上能生产钼的质量为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】丹参醇是存在于中药丹多中的一种天然产物。合成丹参醇的部分路线如下:

已知:![]()
回答下列问题:
(1)C中含氧官能团的名称为_______(写出其中两种)。
(2)写出B的结构简式_______。
(3)下列叙述正确的是_______。
A.D→E的反应为消去反应 B.可用金属钠鉴别D.E
C.D可与NaOH反应 D.丹参醇能发生加聚反应不能发生缩聚反应
(4)丹参醇的所有同分异构体在下列一种表征收器中显示的信号(或数据)完全相同,该仅器是______(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共探仪
(5)芳香化合物F是A的同分异构体,可与FeCl3溶液发生显色反应,F共有_____种;其中核磁共振氢谱为四组峰,峰面积比为6:2:1:1的结构简式为______(写一种即可)。
(6)写出以![]() 和
和 为原料制备
为原料制备![]() 的合成路线流程图__________________(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
的合成路线流程图__________________(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,反应N2O4(g) ![]() 2NO2(g)的焓变为ΔH。现将1mol N2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是( )
2NO2(g)的焓变为ΔH。现将1mol N2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是( )
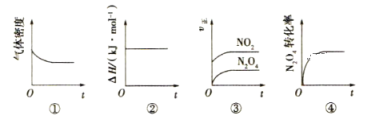
A. ①②B. ②④C. ③④D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于铝的叙述中,正确的是( )
A.铝是地壳中含量最多的金属元素B.铝在常温下不能与氧气反应
C.铝不能与强酸或强碱发生反应D.电解熔融的氯化铝可制得铝单质
查看答案和解析>>
科目: 来源: 题型:
【题目】在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg/cm-3,质量分数为ω,其中含NH4+的物质的量为b moL.下列叙述中正确的是( )
A. 溶质的物质的量浓度c=1000a/35Vmol/L
B. 溶质的质量分数为ω=a /(Vρ-a)×100%
C. 溶液中c(OH-)=1000b/Vmol/L+c(H+)
D. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.Fe3+、Cu2+、Cl-、SO42-B.Fe2+、H+、Cl-、MnO4-
C.H+、ClO-、Cl-、SO42-D.K+、Fe3+、SO42-、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com