
科目: 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.Cu2+、K+、SO42-、NO3-B.Na+、H+、Cl-、HCO3-
C.Na+、NH4+、OH-、Cl-D.H+、K+、SO42-、CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关盐酸与氢氧化钠溶液混合发生反应的说法中,不正确的是( )
A.该反应是放热反应B.该反应是离子反应
C.该反应属于复分解反应D.该反应属于氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置进行实验(夹持仪器省略)。将液体A逐滴加入到固体B中,回答下列问题:
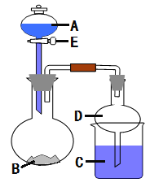
(1)图中盛放液体A的仪器名称为_________________,D装置在实验中的作用是_______________________。
(2)若A为浓盐酸,B为KMnO4,C中盛有KI-淀粉溶液,旋开E后,C中的现象为____________;C中发生反应的离子方程式为__________;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的化学方程式: ______。
(3)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是__________,C中发生反应的离子方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
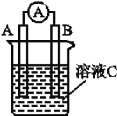
【题目】 (1)如图所示,若溶液C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为_________,A电极的电极反应式为____________;反应进行一段时间后溶液C的酸性会____(填“增强”“减弱”或“基本不变”)。
(2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是______(填化学名称),负极反应为___________;正极反应为_________。
(3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32---4e-![]() 4CO2,则正极反应式为_____,电池总反应式为______。
4CO2,则正极反应式为_____,电池总反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】金刚石和石墨是碳元素的两种同素异形体,在100 kPa时,1 mol石墨转化为金刚石,要吸收1.895 kJ的热量.试判断在100 kPa压强下,下列结论正确的是( )
A.石墨比金刚石稳定
B.金刚石比石墨稳定
C.1 mol石墨比1 mol金刚石的总能量高
D.石墨转化为金刚石是物理变化
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图____________。
(2)写出Y元素最高价氧化物的水化物与NaOH溶液反应的离子方程式______________
(3)写出Y的价电子排布式_________________________。
(4)元素T与氯元素相比,非金属性较强的是_______(用元素符号表示),下列表述中能用于证明这一事实的是_______(填字母代号)。
A.气态氢化物的挥发性 B.两元素的电负性
C.含氧酸的酸性 D.氢化物中X—H键的键长(X代表T和Cl两种元素)
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是___(填元素符号)
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成S、C、Si三种元素的非金属性强弱比较的实验研究。乙同学设计了如图装置来验证卤族元素的性质递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)如图中仪器A的名称是____。甲同学实验步骤:连接仪器、______、加药品、滴入试剂。
(2)①如图中仪器A中盛放试剂稀硫酸,烧瓶B中的盛放试剂为___溶液,C中的盛放试剂为______溶液。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________。
(3)如图中A处反应的离子方程式为__________。
(4)乙同学发现如图中B处试纸变蓝,C处红纸褪色,据此____(填“能”或“不能”)得出溴的非金属性强于碘,理由是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】[选修3:物质结构与性质]东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
氨的沸点______(填“高于”或“低于”)膦(PH3),原因是_________________
氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为______。
(3)单质铜及镍都是由______键形成的晶体;元素铜与镍的第二电离能分别为ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol-1,ICu>INi的原因是_______________________________。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍。A的一种原子中,质量数与质子数之差为零。D元素原子的最外层电子数为m,次外层电子数为n。E元素原子的L层上电子数为(m+n),M层上电子数为![]() 。请回答下列问题:
。请回答下列问题:
(1)B元素是________,D元素在周期表中的位置是________。
(2)C与E形成的化合物E3C属于________(填“原子”“离子”或“分子”)晶体。
(3)由A、D、E元素组成的化合物中存在的化学键类型是________。
(4)写出一个E和D形成的化合物与水反应的离子方程式:_________________________。
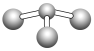
(5)已知:甲+H2O→丙+丁,该反应不是氧化还原反应。若甲是由N和Cl元素组成的化合物,其分子结构模型如下图所示,丙具有漂白性。丁与H2O有相同的电子总数,则丁的电子式为_________________。
(6)与D同主族且上下相邻的元素M、N,原子电子层数M>N>D,三种元素的氢化物的稳定性由大到小的顺序是________________________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com