
科目: 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是
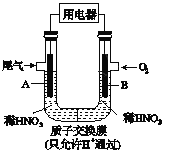
A. 电极A表面反应之一为NO2-e-+H2O= NO3_+2H+
B. 电极B附近的c(NO3_)增大
C. 电解质溶液中电流的方向由B到A,电子的流向与之相反
D. 该电池工作时,每转移4mol电子,消耗22.4L O2
查看答案和解析>>
科目: 来源: 题型:
【题目】图为周期表的一部分,已知A,B,C,D,E五种元素原子核外共有85个电子,E原子核外有四个电子层,B元素是( )
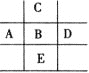
A. PB. MgC. ClD. S
查看答案和解析>>
科目: 来源: 题型:
【题目】“价——类”二维图是学习元素化合物知识的好方法,依据图中氮元素及其化合物的转化关系,回答问题:
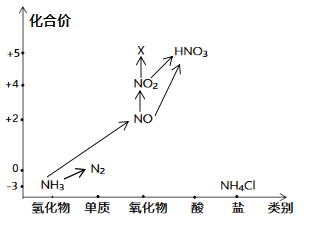
(1)图中,X的化学式为_____,从N元素的化合价看,X具有_____性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为______。
②下列试剂不能用于干燥NH3的是______(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③请写出NH3→NO的化学方程式_____________ 。
④工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
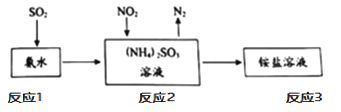
请写出反应2中NO2被吸收过程的化学反应程式是_____。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。SCR(选择性催化还原)工作原理:
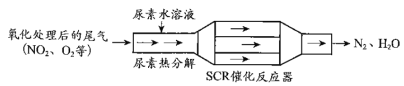
①已知尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出SCR催化反应器中NH3还原NO2的化学方程式:_________。
②尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol 1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】冶炼金属一般有下列4种方法:①焦炭法;②水煤气法(或氢气、或一氧化碳)法;③活泼金属置换法;④电解法。4种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析不正确的是
A. (Ⅰ)用① B. (Ⅱ)用② C. (Ⅲ)用③ D. (Ⅳ)用④
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______________、_________________。
(2)操作I为__________________操作Ⅱ为______________
(3)方案I中如何判别加入的氯化钡已经过量______________________________
(4)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(5) 在方案Ⅱ中发生的离子反应方程式为__________________________
(6)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(7)有同学模仿方案I,提出方案Ⅲ:取50.00 mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果。
根据方案Ⅲ,从理论上讲,下列说法正确的是________(填序号)
a.方案I比方案Ⅲ的计算结果要低
b.方案I比方案Ⅲ的计算结果要高
c.m1=m2 ,方案I和方案Ⅲ的结果一样
d.方案Ⅲ不应根据方案I的方法计算
(8)上述实验中,由于操作错误所引起的实验误差分析正确的是__________(填序号)。
a.方案I中如果没有洗涤操作,实验结果将偏小
b.方案I中如果没有操作Ⅱ,实验结果将偏大
c.方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d.方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大
查看答案和解析>>
科目: 来源: 题型:
【题目】化学来源于生活又服务于生活,化工生产是指对原料进行化学加工,最终获得有价值的产品的生产过程。某研究小组利用含硫酸亚铁和硫酸铜的工业废料制备铁红(氧化铁)和硫酸铵晶体。流程如下:

请回答下列问题:
(1)操作I的名称________________,滤渣的成分为__________________。
(2)简述下列实验操作:
①检验溶液A中金属阳离子的方法为____________________________________________________;
②检验固体B是否洗涤干净的方法是____________________________________________________。
(3)请写出溶液A中反应的离子方程式_______________________________________________________
(4) 测定废料中硫酸铜的质量分数:称取a g废料样品,将操作I得到的滤渣用足量的稀硫酸溶解、过滤、洗涤、干燥,称得固体的质量为b g,则废料中硫酸铜的质量分数为_______________(写出表达式。)
(5) 某同学提出另一种制备铁红的方法:往工业废水中加入足量的硫酸和双氧水,通过下列操作也可以得到铁红,请配平下列离子方程式_____ Fe2++ _____ H2O2 + _____ H+= _____ Fe3+ + ____ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
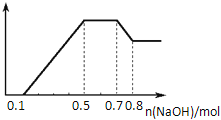
A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1) 写出镍原子的电子排布式_____________。
(2) 丙酮( )分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
)分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
(3)含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成_______molAgCl沉淀。
(4)H2O分子的键角比H2S分子的键角大,原因是_______ 。
(5)N,P属于同族元素,但是它们的简单氢化物NH3,PH3在水中溶解度差异很大,其原因是 _________
(6) 由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。
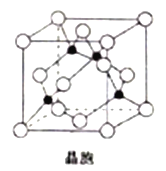
①该晶体的化学式为_______。
②将晶胞内的4个黑点相互连接所形成的立体构型是_______。
③晶体中与一个氯原子距离最近的氯原子有_______个。
④已知该晶体的密度为ρg.cm-3,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为_______pm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com