
科目: 来源: 题型:
【题目】(化学一选修5:有机化学基础)有机物H是一种中枢神经兴奋剂,其合成路线如下图所示。
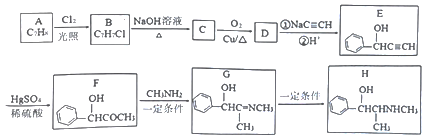
请回答下列问题:
(1)A的化学名称为______,C的结构简式为________。
(2)E中官能团的名称为______。B→C、G→H的反应类型分别为____、______。
(3)D分子中最多有___个原子共平面。
(4)F→G历经两步反应,第一步反应的化学方程式为_______。
(5)同时满足下列条件的F的同分异构体有___种(不考虑立体异构)。
①能发生银镜反应; ②能与氯化铁溶液反应; ③分子中只有1个甲基。
其中核磁共振氢谱有6组峰的结构简式为___________。
(6)最近网上流传,某明星的天价童颜针,其主要成分为聚乳酸,结构简式为 ,它是具有填充、紧致、提拉多重效果的微整形新武器,且具有生理兼容性与可降解性,比传统的硅胶填充整容要先进。参照上述合成路线,以丙烯为原料制备
,它是具有填充、紧致、提拉多重效果的微整形新武器,且具有生理兼容性与可降解性,比传统的硅胶填充整容要先进。参照上述合成路线,以丙烯为原料制备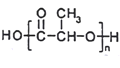 的合成路线流程图(无机试剂任选)____________________。
的合成路线流程图(无机试剂任选)____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,B、 D是中学化学常见金属,D在生活中应用最广泛。

(1)写出物质A与盐酸反应的离子方程式_____。
(2)探究A和B反应后固体的性质:将反应后容器中的残余固体置于烧杯中,加入100mL稀硝酸,固体完全溶解, (假设固体全部溶解后溶液体积不变),反应过程中无气体放出 (活泼金属可把稀HNO3还原为NH4NO3)。向反应后的溶液中缓慢滴加4mol·L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积的关系如图所示:
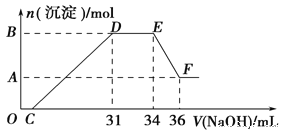
①写出DE段发生反应的离子方程式:_____。
②B与A的差值为_____mol。
③求c(HNO3)=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学一选修3:物质结构与性质)1735年瑞典化学家布兰特(G·Brands)制出金属钴。钴的矿物或钴的化合物一直用作陶瓷、玻璃、珐琅的釉料。到20世纪,钴及其合金在电机、机械、化工、航空和航天等工业部门得到广泛的应用,并成为一种重要的战略金属。所以钴及其化合物具有重要作用,回答下列问题:
(1)基态Co原子的电子排布式为___________。
(2)[Co(NH3)5H2O]Cl3是一种砖红色的晶体,可通过CoCl2、NH4Cl、浓氨水、H2O2制得。
①Co、N、0原子的第一电离能由大到小的顺序是__________。
②[Co(NH3)5H2O]Cl3中Co元素化合价为____,其配位原子为_____;1mol该晶体中含有____molσ键。
③H2O2中O原子的杂化轨道类型是______,H2O2能与水互溶,除都是极性分子外,还因为____。
④NH3、NF3的空间构型都相同,但Co3+易与NH3形成配离子,而NF3不能。原因是________。
(3)CoO晶胞如图,已知Co原子半径为apm,O原子半径为bpm,则等距最近的所有O原子围成的空间形状为_____;该晶胞中原子的空间利用率为__________(用含a、b的计算式表示)。
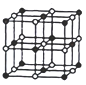
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.石油、煤、天然气都属于化石燃料
B.油脂在碱性条件下的水解反应又称为皂化反应
C.分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体
D.麦芽糖是还原性糖
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于二氧化硅的说法中错误的是 ( )
A.二氧化硅分子是由一个硅原子和两个氧原子构成的
B.在二氧化硅晶体中,每个硅原子与4个氧原子相连
C.石英、水晶、玛瑙的主要成分都是二氧化硅
D.自然界中二氧化硅主要存在于石英矿和硅酸盐中
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)如图装置A烧瓶内试剂可选用______(填序号);①浓硫酸 ②碱石灰 ③五氧化二磷 ④烧碱固体;实验室制取氨气常用另外一种固体和固体加热的方法,写出该方法的化学方程式______________________。
(2)若探究氨气的溶解性,上图需在K2的导管末端连接下图装置中的_________装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是______________________。
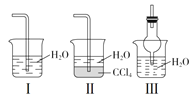
(3)若探究氨气的还原性,需打开K1、K3,K2处导管连接制取纯净、干燥氯气的装置,D中氨气与氯气反应产生白烟,该反应的化学方程式为__________________。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为__________,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为_____g(小数点后保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的。请回答下列问题:

(1)描述D在元素周期表中的位置:_____________________________。
(2)在A、B、C、E四种元素最高价氧化物对应的水化物中酸性最强的是__________(写化学式,下同),非金属最简单气态氢化物最不稳定的是_____________________。
(3)写出满足下列条件分子的结构式_________________________
①所有原子最外层是8个电子; ②C和E组成的化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)工业上氨气的催化氧化反应的化学方程式_____________
(2)偏铝酸钠溶液中通入过量二氧化碳的离子方程式_____________;
(3)根据部分键能数据,以及热化学方程式CH4(g)+4F2(g) = CF4(g)+4HF(g)
ΔH =-1940 kJ·mol-1,计算H—F键的键能为______________。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | ? | 155 |
(4)0.1mol的氯气和焦炭、TiO2固体完全反应,生成TiCl4液体和一种还原性的气体,放出热量4.28kJ,写出该反应的热化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨的合成对社会发展与进步有巨大贡献。
(1)某温度下,在容积均为2L的两个密闭容器中分别发生反应。N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0kJ/mol。相关数据如下:
2NH3(g) △H=-92.0kJ/mol。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molN2(g)和3molH2(g) | 2molNH3(g) |
平衡时c(NH3) | c1 | c2 |
平衡时能量变化 | 放出18.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到中平衡状态的是_____(填字母)。
A.3v(N2)正=v(H2)逆 B.N2、H2的浓度之比不再随时间改变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子质量不变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_____ (填字母)。
A.升高温度 B.充入更多的H2 C.移除NH3 D.压缩容器体积
③c1__c2(填“>”“<”或“=”)。
(2)合成氨也可以采用电化学法,其原理如右图所示。则阴极的电极反应式是_________。

(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-906kJ/mol
4NO(g)+6H2O(g) △H=-906kJ/mol
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1267kJ/mol
2N2(g)+6H2O(g) △H=-1267kJ/mol
①该条件下,N2(g)+O2(g)![]() 2NO(g) △H=_____kJ/mol
2NO(g) △H=_____kJ/mol
②为分析催化剂对反应的选择性,在1L密闭容器中充入1molNH3和2molO2,在一定时间内测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应___填“反应I”或“反应II”)。当温度高于840℃时,反应I中NO的物质的量减少的原因是________。520℃时,反应I的平衡常数K=____(只列算式不计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com