
科目: 来源: 题型:
【题目】四个试管中都装有5 mL 0.1 mol·L-1Na2S2O3溶液,分别在不同温度下加入0.1 mol·L-1硫酸和一定量水,最先出现浑浊的是
A.20 ℃,10 mL硫酸B.20 ℃,5 mL硫酸和5 mL水
C.30 ℃,10 mL硫酸D.30 ℃,5 mL硫酸和5 mL水
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化锡(SnCl4)用作媒染剂和有机合成上的氯化催化剂。实验室制备四氯化锡的装置如下图(部分夹持装置已略去)。已知:①金属锡熔融时通入干燥氯气反应可生成四氯化锡;②无水四氯化锡熔点-33℃,沸点114.1℃;③无水四氯化锡遇水蒸气生成白色烟雾。下列说法不正确的是

A. ①、②、⑥、⑦的试管中依次盛装MnO2、饱和食盐水、浓H2SO4、NaOH溶液
B. 实验时滴加浓盐酸反应一段时间,然后再点燃④处的酒精灯
C. ⑤装置用于收集SnCl4,浸泡在冷水浴中效果更好
D. ⑥、⑦两个试管可以用一个装有碱石灰的干燥管来代替
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种强氧化性气体(高浓度时呈红黄色,低浓度时呈黄色),在消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过下图所示装置(夹持装置略)对其进行制备、收集、吸收并制取NaClO2。

(1)仪器A的名称是______。
(2)图中装置有一明显错误,请指出:______。
(3)打开B的活塞,A中有ClO2生成,D中吸收ClO2后生成NaClO2和NaHCO3,写出D中所发生反应的离子方程式:______。
(4)E中溶液出现黄色能否说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,判断并说明理由:______。
(5)写出一种提高ClO2吸收率的方法:______。
(6)E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO2—,当pH≤2.0时,ClO2—能被I—还原。请补充完整检验E装置溶液中存在少量ClO2—的实验方案:取一定体积E装置中的溶液于分液漏斗中,______,则溶液中存在ClO2—。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量是高中化学中常用的物理量,请完成以下有关其计算的内容。
(1)0.2 g H2含有___________________个H原子。
(2)标准状况下,含有相同氧原子数的CO与CO2的体积之比为__________。
(3)100 mL 某Al2(SO4)3溶液中,c(Al3+) = 2.0 mol/L,则其中c(SO42-) = _________mol/L。
(4)工业上利用下列反应进行海水中溴元素的富集:Br2 + SO2 + 2H2O = H2SO4 + 2HBr 。若反应中生成了 0.2 mol HBr,则消耗SO2的体积(标准状况)是________________L。
(5)当SO2、SO3的分子个数之比为1:2时,原子总数之比为___________,质量之比为________;
查看答案和解析>>
科目: 来源: 题型:
【题目】碳铵是一种较常使用的化肥,它在常温下易分解.某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究.
(定性实验)检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色.
(1)根据实验现象,推测碳铵中所含有阴离子可能是_________和__________;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是________________;
(定量试验)测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示.
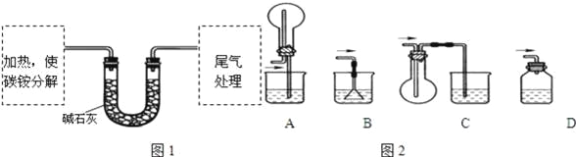
(3)碳铵固体应放在________中进行加热.
A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
(4)从安全的角度考虑,尾气处理的装置可以选用如图2中的___________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_________g.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列示意图与对应的反应情况符合的是

A. 向含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C. 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D. 向含有少量氢氧化钠的NaAlO2溶液中逐滴加入盐酸至过量
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

已知::2NO2+2NaOH=NaNO3+NaNO2+H2O;NO+NO2+2NaOH=2NaNO2+H2O。
(1)固体1的主要成分除Ca(OH)2外,还有__________ 、________ (填化学式);
(2)步骤Ⅱ中需要的O2量应是_____(填“少量”或“过量”);步骤Ⅴ最终捕获剂捕获的气体产物是________;
(3)步骤Ⅳ处理含NH4+废水时,发生反应的离子方程式为__________________;
(4)为确保步骤Ⅲ无NaNO3生成,理论上应控制NO与O2的物质的量之比为_____,若n(NO) :n(O2)=5:2且NaOH溶液足量,则步骤Ⅲ所得溶液中NaNO3与NaNO2的物质的量之比为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有三组混合液:①汽油和水;②75%的酒精溶液;③碘的水溶液,分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 分液、蒸馏、萃取
C. 萃取、蒸馏、分液 D. 蒸馏、萃取、分液
查看答案和解析>>
科目: 来源: 题型:
【题目】KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:
①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液进行处理可获得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是___________________。
(2)写出第②步中发生反应的离子方程式____________。
(3)第③步中从滤液中获得KMnO4晶体的方法是______、_______、过滤、洗涤、干燥。
(4)取上述制得的KMnO4产品2.0000g,溶于水配成250mL溶液,取出25.00mL于碘量瓶中,加入稀硫酸和足量碘化钾并放于暗处5min左右,然后加入适量水和数滴淀粉溶液作指示剂,用0.2500mol/L标准Na2S2O3溶液进行滴定(发生反应I2+2S2O32-=2I-+S4O62-,杂质不参加反应),滴定至终点消耗Na2S2O3溶液20.00mL。
①滴定终点的现象是_____________。
②计算KMnO4产品的纯度。(写出计算过程)_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】将一块镁铝合金溶于盐酸后,加入过量氢氧化钠溶液,过滤后灼烧沉淀物,所得白色粉末的质量等于原合金的质量,则该合金中镁铝的质量比是( )
A.3:2B.2:3C.1:1D.2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com