
科目: 来源: 题型:
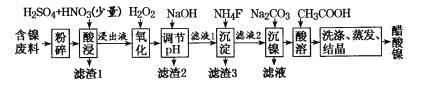
【题目】醋酸镍((CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
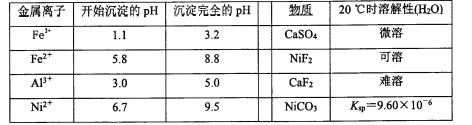
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
(1)粉碎含镍废料的作用__________________________________
(2)酸浸过程中,l molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:___。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:____。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是____。
(5)滤渣3主要成分的化学式是____。
(6)沉镍过程中,若c(Ni2+)= 2.0 mol.L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为____g(保留一位小数)。
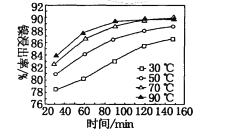
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为____℃、______min。
查看答案和解析>>
科目: 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A. B.
B.
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
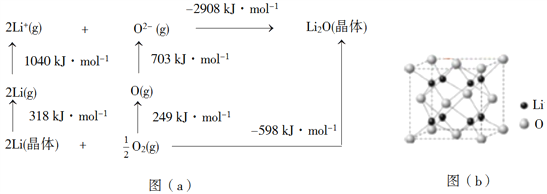
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
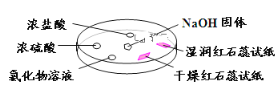
选项 | 实验现象 | 解释 |
A | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是MgCl2溶液 |
D | 浓盐酸附近产生白烟 | NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】若20 g密度为ρ g·cm-3的Ca(NO3)2溶液中含有2 g Ca2+,则溶液中NO的物质的量浓度为( )
A. 5ρ mol·L-1 B. 2.5ρ mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
①静电除尘利用了胶体带电的性质
②水玻璃可用作制备木材防火剂的原料
③光导纤维和计算机芯片的主要成分是SiO2,太阳能电池的主要成分是硅
④常温下,铝制容器盛放稀硫酸
⑤三氧化二铝可以做耐火材料
A. ②⑤ B. ①③④ C. ①③⑤ D. ②④
查看答案和解析>>
科目: 来源: 题型:
【题目】自来水常用二氧化氯(ClO2)来杀菌消毒,它能转化为可溶性氯化物,市场上有些不法商贩为牟取暴利,用自来水冒充纯净水出售,为辨别纯净水的真伪,你想选用的化学试剂是( )
A.氯化钡溶液B.石蕊试液C.硝酸银溶液D.氢氧化钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中错误的是 ( )
A.在豆浆中加少量石膏,能使豆浆凝结成豆腐
B.误服可溶性重金属盐,立刻服用大量的牛奶或蛋青解毒
C.用灼烧的方法可鉴别毛织物和棉织物
D.温度越高,酶对某些化学反应的催化效率越高
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 液态HCl不导电,所以HCl是非电解质
B. BaSO4溶于水的部分能够电离,所以BaSO4是电解质
C. 液态Cl2不导电,所以Cl2是非电解质
D. NH3的水溶液能够导电,所以NH3是电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列选项正确的是
![]()
A.Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
B.Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C.Na2S4O6、H2O、Na2S2O3、Au2O、NaOH
D.当1 mol Au2O3完全反应时,转移电子的物质的量为8 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com