
科目: 来源: 题型:
【题目】甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
步骤 | 操作 | 现象 |
I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ +![]() SO32- +
SO32- +![]() =
=![]() F e2+ +
F e2+ +![]() +
+![]()
![]()
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
步骤 | 操作 | 现象 |
II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
步骤 | 操作 | 现象 |
III | 向1 molL-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是________(填写化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为______________________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5 mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4 h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4 h后红纸褪色 |
已知,溶液中Cl2、HClO和ClO-物质的量分数(α)随溶液pH变化的关系如下图所示:
![]()

①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3,每生成0.5 mol ClO2,转移________mol e-。
查看答案和解析>>
科目: 来源: 题型:
【题目】假如你是某化工厂的总工程师,为了加快化学反应速率进而提高经济效益,你应优先考虑的措施是
A.选用适宜的催化剂B.采用高压
C.采用高温D.增大反应物的浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_____。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如图:
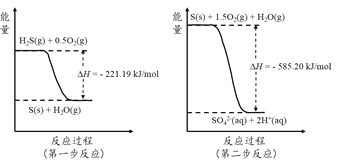
1mol H2S(g)全部氧化成SO42-的热化学方程式为___________________________。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如图:
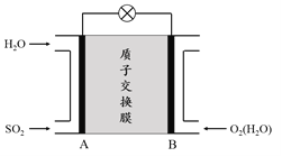
①质子的流动方向为_______________________。(“从A到B”或“从B到A”)。
②负极的电极反应式为_________________________________________________________________________________________。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如图:
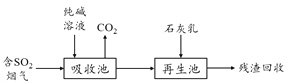
①用纯碱溶液吸收SO2,将其转化为HSO3-,反应的离子方程式是_________________。
②若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),△H2
CH3OH(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示)___________ mol/(L·min)。
(2)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。

(1)用离子方程式解释现象Ⅰ中出现胶状沉淀的原因:_____________。
(2)Ⅱ中加碱时出现的现象是_______________,此现象说明溶液中发生反应的离子方程式是____________________________________。
(3)Ⅲ中加碱时出现的现象是_____________________________________。
(4)用离子方程式解释Ⅳ中加碱时出现的现象:____________________________________。
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。

①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL 0.1mol/LFe(NO3)2溶液中______________,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1mol/LFe(NO3)2溶液中的Fe2+被NO3-氧化;
b.______________________(用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氡是放射性元素,氡气吸入人体有害健康。氡的原子序数是86,相对原子质量是222。科学家还发现某些放射性矿物分解放出的“锕射气”是由质子数为86、质量数为219的原子组成。下列关于氡的说法正确的是( )
A. 氡气在标准状况下的密度 9.91 g·L-1
B. 氡气的化学性质较活泼,因此对人体有害
C. 氡原子核外有7个电子层,最外层有8个电子
D. “锕射气”是氡的同素异形体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是
A. 浓硝酸保存在棕色试剂瓶中并放置在阴凉处
B. 少量的金属钠保存在煤油中
C. 液溴应保存在棕色细口瓶中,并加水液封
D. 新制的氯水通常保存在无色细口瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某同学将等体积的甲烷与氯气混合于一试管中,倒扣在盛饱和食盐水的水槽里,然后置于光亮处。一段时间后的现象正确的是:_____;
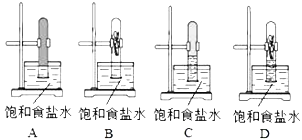
(2)反应后试管中所得有机产物化学式为______________;(有几种写几种)
(3)写出甲烷与氯气反应第一步的化学方程式_________;
(4)在同温同压下,甲烷的同系物A的蒸汽密度是甲烷密度的4.5倍,其分子式__;
(5)A有____种同分异构体;写出其有三个甲基的同分异构体的结构简式___;
(6)A的某同分异构体只有一种一氯代物,请用系统命名法为该同分异构体命名_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com