
科目: 来源: 题型:
【题目】我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
(1)Cu2+的未成对电子数有______个,H、O、S电负性由大到小的顺序为_______。
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。[Cu(NH3)4]SO4中化学键类型有_______,阴离子中心原子杂化类型为______。
(3)铁铜合金晶体类型为_____;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因________________。
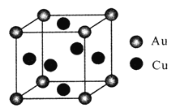
(4)金铜合金的一种晶体结构为立方晶型,如图所示。已知该合金的密度为dg/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为_______cm(写出计算表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
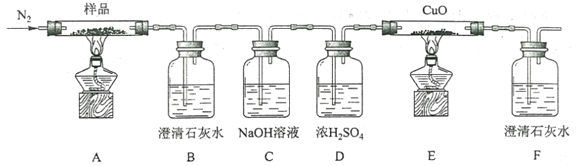
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内:________
![]()
![]()
(2)反应中,被还原的元素是______________,还原剂是___________。
(3)请将反应物的化学式配平后的系数填入下列相应的位置中,并标出电子转移的方向和数目。________
![]()
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂的物质的量之比为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且c(Cl-)/c(ClO-)的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A. 若某温度下,反应后c(Cl-)/c(ClO-)=11,则溶液中c(ClO-)/c(ClO3-)=1/2
B. 参加反应的氯气的物质的量等于a/2 mol
C. 改变温度,反应中转移电子的物质的量ne的范围:![]() a mol≤ne≤
a mol≤ne≤![]() a mol
a mol
D. 改变温度,产物中KC1O3的最大理论产量为![]() a mol
a mol
查看答案和解析>>
科目: 来源: 题型:
【题目】部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:下列说法正确的是( )

A. 滤液A中的阳离子为Fe3+、Fe2+、H+
B. 样品中CuO的质量为4.0 g
C. 样品中Fe元素的质量为2.24 g
D. V=896
查看答案和解析>>
科目: 来源: 题型:
【题目】以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是
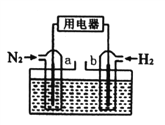
A. b电极为负极
B. 反应过程中,溶液中的Cl-向a电极移动
C. a电极的电极反应式为:N2+6e-+8H+=2NH4+
D. 电池反应为N2+3H2+2HCl=2NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:

①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。

(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中各有两对物质,它们都能用分液漏斗分离的是( )
A. 乙酸乙酯和饱和碳酸钠溶液,酒精和水
B. 1,1-二溴乙烷和水,硝基苯和水
C. 汽油和水,乙酸和乙醇
D. 乙酸和水,植物油和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com