
科目: 来源: 题型:
【题目】已知A、B、C、D、E是短周期的五种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为淡黄色晶体,易溶于二硫化碳。
(1)请写出A、E元素的名称:A__________,E____________;
(2)画出C元素的离子结构示意图_____________________;
(3)写出C、D的最高价氧化物对应水化物相互反应的化学方程式________________________;
(4)A、B、C三种元素形成的化合物所含的化学键类型为______________________________;
(5)B、C、D、E四种元素的原子半径由大到小的排列顺序为_________________(用元素符号表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):
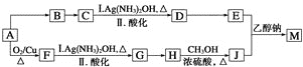
已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;
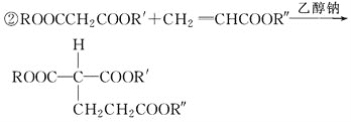
(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚异戊二烯橡胶(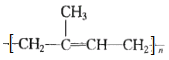 )具有与天然橡胶相似的化学组成、立体结构和力学性能,具有良好的强度、黏性和弹性等,其合成路线如下图:
)具有与天然橡胶相似的化学组成、立体结构和力学性能,具有良好的强度、黏性和弹性等,其合成路线如下图:

已知:
①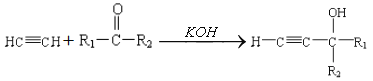 ;
;
②同一碳原子上有两个碳碳双键时分子不稳定。
(1)A既能使酸性KMnO4溶液褪色,也能使溴的四氯化碳溶液褪色,则A的化学名称是__________,该物质中含有的官能团名称是______________。
(2)![]() 和氧气作反应物,温度为110℃时除生成B外,还生成一种副产物F,其分子式为C6H6O,该物质的水溶液遇FeCl3溶液显紫色,那么物质F不可能发生的反应类型是_________。
和氧气作反应物,温度为110℃时除生成B外,还生成一种副产物F,其分子式为C6H6O,该物质的水溶液遇FeCl3溶液显紫色,那么物质F不可能发生的反应类型是_________。
a.加成反应 b.取代反应 c.消去反应 d.缩聚反应
(3)写出合成路线图中有机化合物C的结构简式___________________。
(4)写出D生成E的化学反应方程式_____________。
(5)D的同分异构体中能发生银镜反应的共有______种,其中核磁共振氢谱有五种不同化学环境的氢,且峰面积比为3:3:2:1:1是______________(写结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列装置属于原电池的是___________;

(2)在选出的原电池中,______ 是负极,发生______(氧化、还原) 反应 ,______ 是正极 ,该极的现象___________________________;
(3)在该原电池的内电路中,硫酸根离子移向_________(正、负)极。
(4)此原电池反应的化学方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
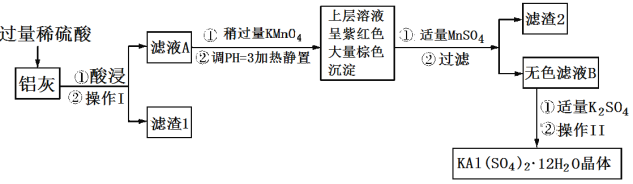
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4—转化为Mn2+):________________。
(5)已知:在pH=3、加热条件下,MnO![]() 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
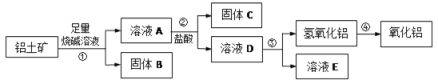
(1)第③步中,生成氢氧化铝的离子方程式是____________________。
(2)如果把步骤②中适量的盐酸改为过量的二氧化碳,则反应的离子方程式____。
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是__________(保留一位小数)。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1mol电子,反应的化学方程式是____________________。
(II)大量燃煤产生烟气会造成空气中二氧化硫含量增多,某研究小组利用燃煤电厂的固体废弃物粉煤灰(主要含Al2O3、SiO2等)进行烟气脱硫研究,并制备Al2(SO4)3·18H2O。
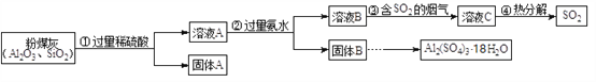
(5)第②步不能用氢氧化钠溶液的原因是_____________(用化学方程式表示)。
(6)下列关于步骤③、④的说法正确的是_______。
a.溶液C可用于制备氮肥
b.溶液B中的硫酸铵将烟气中的SO2除去
c.热分解获得的SO2可以回收再利用
(7)从固体B制备Al2(SO4)3·18H2O的实验操作是:加入稀硫酸、加热浓缩、_________、过滤。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图:
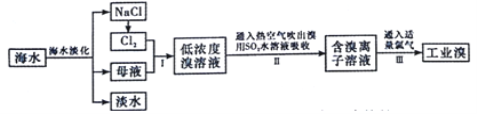
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是______.
A.NaOH溶液→碳酸钠溶液→氯化钡溶液→过滤后加盐酸
B.氯化钡溶液→氢氧化钠溶液→碳酸钠溶液→过滤后加盐酸
C.NaOH溶液→氯化钡溶液→碳酸钠溶液→过滤后加盐酸
D.碳酸钠溶液→氢氧化钠溶液→氯化钡溶液→过滤后加盐酸
(2)写出Ⅱ中发生反应的离子方程式:______.
(3)从理论上考虑,下列物质也能吸收的是______
A.NaOH![]()
![]()
![]()
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是______.
(5)已知某溶液中Cl-、Br-、I-的物质的量之比为3:4:5,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成3:2:1,那么要通入氯气的物质的量是原溶液中I-的物质的量是______
A.1/2B.1/10C.3/10D.1/5
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为1nm~l00nm的红褐色液相分散系。则该反应的化学方程式为____________________________。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL6mol/L的B溶液中逐滴滴入100mL某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为________________。
(3)将A、B中两种金属元素的单质用导线连接,插入一个盛有KOH溶液的烧杯中构成原电池,则电池反应为_______________________。
(4)C、D、E均是短周期中同一周期元素形成的单质或化合物,常温下D为固体单质,C和E均为气态化合物,且可发生反应:C+D![]() E。将一定量的气体C通入某浓度的KOH溶液得溶液F,向F溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(C)的关系如图所示,则生成F的离子方程式______________________。
E。将一定量的气体C通入某浓度的KOH溶液得溶液F,向F溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(C)的关系如图所示,则生成F的离子方程式______________________。
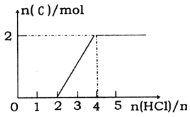
查看答案和解析>>
科目: 来源: 题型:
【题目】向10mL![]() NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A. x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
B. x=10时,溶液中有NH4+、AlO2-、SO42-,且 c(NH4+)>c(SO42-)
C. x=30时,溶液中有Ba2+、AlO2-、OH-,且 c(OH-)<c AlO2-)
D. x=30时,溶液中有Ba2+、Al3+、OH-,且 c(OH-)=c(Ba2+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com