
科目: 来源: 题型:
【题目】下列有关工业生产的叙述正确的是( )
A.海水中碘的总藏量很大,工业上直接用海水提取碘
B.工业上用电解饱和食盐水的方法制备金属钠
C.工业上用加热分解次氯酸的方法生产盐酸
D.工业上用钠与熔融的四氯化钛反应制取金属钛
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
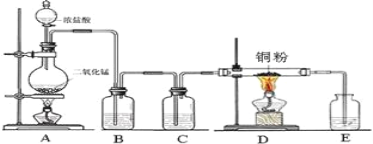
(1)连接好装置,装药品之前,必须进行的一项操作步骤是____________________。
(2)发生装置中盛放浓盐酸的仪器为___________,盛放二氧化锰的仪器为________________。
(3)写出烧瓶中发生反应的化学方程式:____________________________________________。
(4)B处盛有饱和食盐水,其作用是_________________________________________________。
(5)C处盛放的试剂_________,其作用是____________________________________________。
(6)E处发生反应的离子方程式为___________________________________________________。
(7)实验结束时,应先熄灭__________(填A或D)处酒精灯。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。

已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是____________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是______________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用______(填“酸”或“碱”)式滴定管取20.00 mL次氯酸溶液,加入足量的______,再加入足量的______,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等。
(1)如下图所示实验,反应的化学方程式为_______________。实验结束后,向试管所得溶液中滴加酚酞溶液,现象是___________________________。

(2)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧。原因是Na2O2与H2O和CO2反应,其中与CO2反应的化学方程式为______________________。若标准状况下反应生成了5.6LO2,则转移电子的物质的量为______mol。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30%H2O2,反应生成CaO28H2O沉淀;
③经过陈化、过滤,水洗得到CaO28H2O,再脱水干燥得到CaO2。
完成下列填空:
(3)第①步反应的化学方程式为_____________________。
(4)生产中可循环使用的物质是_____________________。
(5)检验CaO28H2O是否洗净的方法是___________。
(6)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(标况),产品中CaO2的质量分数为________(用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关细胞中化合物的说法正确的是 ( )
A. 脂肪存在于所有生物体中 B. 叶绿体和线粒体中都含有葡萄糖
C. 所有生物体中都含有蛋白质 D. 生物体内的核酸都是遗传物质
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式____________。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15 390 | 21 771 |
则A原子的价电子排布式为______________。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气体中的CO(Ac—代表CH3COO—),其反应是:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
[Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
①C、N、O三种元素的第一电离能由小到大的顺序为____________。
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为____________。
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为________;1 mol尿素分子中,σ键的数目为________。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3 ℃,MgO的熔点高达2800 ℃。造成两种晶体熔点差距的主要原因是____________________________________。
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾。其中NH4+的空间构型是____________(用文字描述),与NO互为等电子体的分子是____________(填化学式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示Cu+,白色球表示Cl-),已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为ρ=________g·cm-3(用NA表示阿伏加德罗常数)。
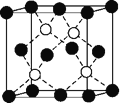
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关细胞中水的叙述,错误的是
A. 细胞内参与物质运输的水是自由水
B. 越冬的动物体内结合水的比例相对较高
C. 同一个体的不同器官的含水量相同
D. 植物蒸腾作用中失去的水主要是自由水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组粒子,互为同位素的是_____(填编号,下同),互为同素异形体的是_______,互为同分异构体的是__________,属于同一种物质的是___________。
① 16O2和18O3 ②质子数相同而中子数不同的两种粒子
③H D T ④ ⑤正丁烷和异丁烷
⑤正丁烷和异丁烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com