
科目: 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)甲组同学取l0mL0.l mol·L-1KI溶液,加入6 mL0.l mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入lmLCCl4充分振荡、静置, CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀:
③第三支试行中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号) ______________;实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号)_______________,由此可以证明该氧化还原反应为___________________(填可逆反应或不可逆反应)。
(2)乙组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__________________________________;生成沉淀的原因是(用平衡移动原理解释)_________________________________________________。
(3)丙组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。
①若酸性FeCl2 废液中:c(Fe2+)=2.0×10-2 mol·L-1,c(Fe3+)=1.0×10-3 mol·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为_____________。
②完成NaClO3氧化FeCl2的离子方程式:□ClO3-+□Fe2++□________=□Cl-+□Fe3++□________。
查看答案和解析>>
科目: 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2HCHO2H2O)俗称吊白块,在印染、医药以及原子能工业中有广 泛应用。以 Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: 已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在 120℃以上发生分解。
步骤 1:在三颈烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,缓慢通入 SO2,至溶液 pH 约为 4,制得 NaHSO3溶液。
步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在 80~90℃下, 反应约 3h,冷却至室温,抽滤;

步骤 3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置 B的烧杯中应加入的溶液是_________;冷凝管中冷却水从_______填“a”或“b”)口进水。
(2)A 中多孔球泡的作用是________。
(3)冷凝管中回流的主要物质除 H2O 外还有________(填化学式)。
(4)写出步骤 2 中发生反应的化学方程式________。
(5)步骤 3 中在真空容器中蒸发浓缩的原因是________。
(6)为了测定产品的纯度,准确称取 2.0g 样品,完全溶于水配成 100mL 溶液,取 20.00mL 所配溶液, 加入过量碘完全反应后(已知 I2 不能氧化甲醛,杂质不反应),加入 BaCl2 溶液至沉淀完全,过滤、洗涤、 干燥至恒重得到白色固体 0.466g,则所制得的产品的纯度为________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于能源和作为能源使用的物质的叙述中错误的是( )
A.化石能源物质内部蕴含着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在一定条件下转化为热能、电能,为人类所利用
D.吸热反应没有利用价值
查看答案和解析>>
科目: 来源: 题型:
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:
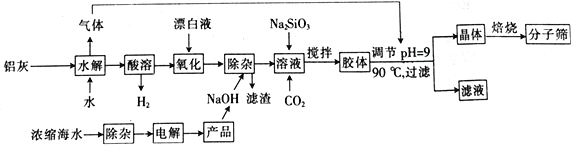
(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式);“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:

已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五种溶液,只用一种试剂把它们区别开,这种试剂是
A. 氨水 B. AgNO3溶液 C. 浓NaOH溶液 D. NaCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-===CO32—+3H2O。
(1)负极上的电极反应为____________________________________。
(2)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)向一定量Fe和Fe2O3的混合物中加入120mL一定浓度的稀硝酸恰好使混合物溶解,同时可得到标准状况下1.344L NO气体.向所得到的溶液中再加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,得到11.76g铁单质.则原稀硝酸的物质的量浓度为( )
A. 2molL-1 B. 4molL-1
C. 5.75molL-1 D. 无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com