
科目: 来源: 题型:
【题目】实验室中Y形管是一种特殊的仪器,通常与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。回答下列问题:

(1)广口瓶中间那根玻璃管的作用是:__________________________________________。
(2)实验前需要将BaCl2溶液煮沸,其目的是:_________________________________。
(3)甲中发生反应的化学方程式为:____________________________________________。
(4)乙中分别加入一种常用氧化物和一种无色液体,常温下将两者混合可产生一种碱性气体。该反应的化学方程式为:____________________________________________。
(5)实验时,先使甲中产生的足量气体通入BaCl2溶液中,始终无沉淀生成。由此得出的结论是_______。
(6)向上述⑸实验所得溶液中通入乙产生的气体,产生白色沉淀,请写出发生反应的离子方程式:_____。
(7) 请指出该实验的一个不足之处:____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() 的晶体类型是 ______ ;
的晶体类型是 ______ ;
![]() 羰基铁
羰基铁![]() 可用作催化剂、汽油抗爆剂等。1mol
可用作催化剂、汽油抗爆剂等。1mol![]() 分子中含______
分子中含______![]() 键;
键;
![]() 氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为 ______ ;
氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为 ______ ;
![]() 氧化亚铁晶体的晶胞如图2所示。已知:
氧化亚铁晶体的晶胞如图2所示。已知:
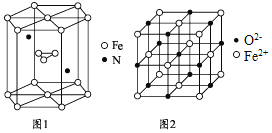
氧化亚铁晶体的密度为![]() ,
,![]() 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与![]() 紧邻且等距离的
紧邻且等距离的![]() 数目为 ______ ;
数目为 ______ ;![]() 与
与![]() 最短核间距为 ______ pm。
最短核间距为 ______ pm。![]() 写出表达式
写出表达式![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】对羟基苯乙酸是合成药物的中间体,其制备路线如下(A为芳香烃):
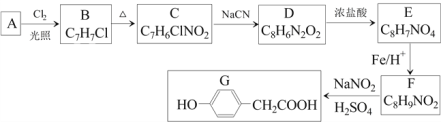

回答下列问题:
(1)A的名称是______________。
(2)B→C的反应试剂是_______ ,反应类型是_______;E→F的反应类型是_______。
(3)C→D反应的化学方程式为________________。
(4)E中含氧官能团的名称为______。
(5)1molG与足量NaOH溶液反应,可以消耗_____molNaOH。
(6)H是G的同系物,满足下列条件的H的同分异构体有_______种(不考虑立体异构)。
① H相对分子质量比G大14 ② 苯环上含两个取代基
其中核磁共振氢谱为六组峰,峰面积之比为1:2:2:2:2:1的结构简式为_____________。
(7)结合以上合成路线及相关信息,设计由苯制备苯酚的合成路线________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究发现,由钴氧化物负载的锰氧化物纳米粒子催化剂对某些反应具有高活性,应用前景良好。回答下列问题:
(1)Mn基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是________;Mn与Co相比,基态原子核外未成对电子数较少的是_______。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)沸点相比较:
①甲醇____H2O(填写“>”“<”或“=”);原因是_____________________________;
②CO2____H2(填写“>”“<”或“=”);原因是________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了π键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为αnm,则r(O2-)为________ nm (用含α的算式表示,不必运算化简,下同)。MnO也属于NaCl型结构,晶胞参数为αˊnm,则r(Mn2+)为________nm(用含α、αˊ的算式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】新能源公交、轻轨、云轨等使淮安交通更加快捷。“车联网”技术定位车辆运行轨迹的光纤材料二氧化硅功不可没,二氧化硅属于
A. 分子晶体 B. 离子晶体 C. 原子晶体 D. 金属晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化属于氮的固定的是
A. 工业上用氨气和硝酸合成硝酸铵
B. 氯化铵受热分解生成氨气和氯化氢
C. 氨气与氯气反应生成氮气
D. 氮气和氧气在放电条件下生成NO
查看答案和解析>>
科目: 来源: 题型:
【题目】在由Na2S、Na2SO3、Na2SO4组成的固体混合物中,已知S的质量分数为25.6%,则氧的质量分数为
A. 36.8%B. 37.6%C. 51.2%D. 无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】铬合金有重要的用途,从其废料中制取铬的流程如下:

已知: ① Cr+H2SO4=CrSO4+H2↑,
② 流程中铬元素浸出之后至生成Cr(OH)3之间均以自由移动离子状态存在于溶液中。
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有:________________________ (写一条即可) 。
(2)用纯碱调节滤液pH,得到某弱碱沉淀,若纯碱过量,则可能导致的后果是_:_____________。
(3)流程中的“副产物”中,可用作可溶性钡盐中毒解毒剂的物质的化学式是___________;可用作化肥的物质的化学式是_____________。
(4)加入草酸实现沉淀转化反应化学方程式为:_______________________________________。
(5)流程中利用铝热反应冶炼铬的化学方程式为:_____________________________________。
(6)流程中由滤液生成Cr(OH)3的化学方程式为:_____________________________________。
(7)除已知反应①之外,整个流程中涉及的主要氧化还原反应有_____个,分解反应有____个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com