
科目: 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下,请根据以上信息和相关知识判断,下列分析不正确的是( )

A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”敞口放置一段时间后浓度会变小
C. 取100 mL该“84消毒液”稀释100倍用以消毒,稀释后溶液中c(Na+)约为0.04mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480 mL,需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目: 来源: 题型:
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
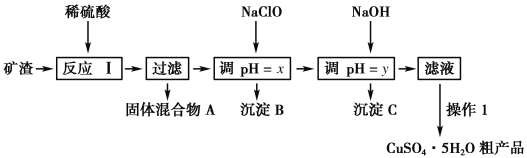
已知:①Cu2O+2H+===Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是____________ (写两条)。
(2)固体混合物A中的成分是________。
(3)反应Ⅰ完成后,铁元素的存在形式为________(填离子符号);写出生成该离子的离子方程式____________。
(4)操作1主要包括:蒸发浓缩、冷却结晶、________。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是______________。
(5)用NaCl0调pH可以生成沉淀B,利用题中所给信息分析沉淀B为_______,该反应的离子方程式为______________.
查看答案和解析>>
科目: 来源: 题型:
【题目】“价——类”二维图是学习元素化合物知识的好方法,依据图中氮元素及其化合物的转化关系,回答问题:
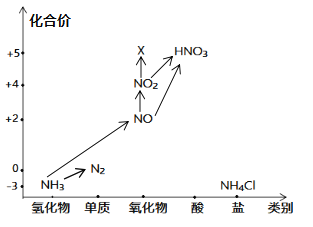
(1)图中,X的化学式为_____,从N元素的化合价看,X具有_____性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为______。
②下列试剂不能用于干燥NH3的是______(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③请写出NH3→NO的化学方程式_____________ 。
④工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
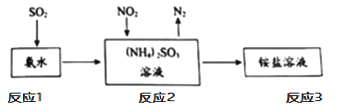
请写出反应2中NO2被吸收过程的化学反应程式是_____。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。SCR(选择性催化还原)工作原理:
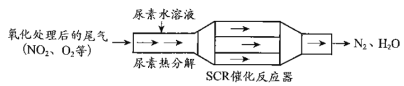
①已知尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出SCR催化反应器中NH3还原NO2的化学方程式:_________。
②尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol 1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示在不同条件下的酶促反应速率变化曲线。据图分析叙述错误的是( )

A. 影响AB段反应速率的主要因素是底物浓度
B. 影响BC段反应速率的主要限制因素可能是酶量
C. 温度导致了曲线Ⅰ和Ⅱ的反应速率不同
D. 曲线Ⅰ显示,该酶促反应的最适温度为37 ℃
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以含有Ca2+、Mg2+、Cl-、SO![]() 、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
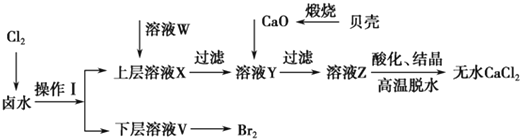
(1)操作Ⅰ使用的试剂是____________,所用主要仪器的名称是________。
(2)加入溶液W的目的是______________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择的pH最大范围是____________。酸化溶液Z时,使用的试剂为__________。
开始沉淀时的pH | 沉淀完全时的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8 mol·L-1 |
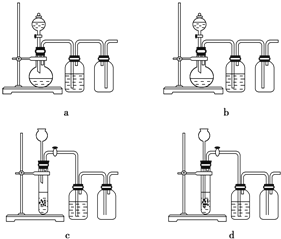
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是__________。
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3的酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于___________________________。用一个化学方程式表示H2SO3酸性强于H2CO3: __________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是( )
A.H+、CO32-、NO3-B.Ca2+、SO42-、CO32-
C.NH4+、Cl-、SO42-D.Ag+、Na+、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明:NO吸入治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究证实,NO对SARS病毒有直接抑制作用。下列对NO的叙述正确的是( )
A.常温常压下,一氧化氮能与空气中的氧气直接化合
B.一氧化氮的摩尔质量为30
C.一氧化氮是一种红棕色的气体
D.一氧化氮易溶于水,不能用排水法收集
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com