
科目: 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3—、SO42—、CO32—,已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀;
已知:向Ag+溶液中滴加氨水,先产生沉淀,继续滴加氨水,沉淀溶解。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是_____;所含阴离子相同的两种盐的化学式是________。
(2)D的化学式为____________,D溶液显碱性的原因是(用离子方程式表示)_____________。
(3)A和C的溶液反应的离子方程式是_______________;E和氨水反应的离子方程式是_______________。
(4)若要检验B中所含的阳离子,正确的实验方法是:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种物质焰色均为黄色,它们按图所示互相转化.
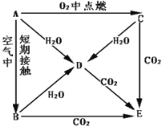
(1)这五种物质中,A:______、C:______.
(2)将CO2通入E的饱和溶液中,该反应的离子方程式为__________________________.
(3)写出A→D、C→D反应的化学方程式
A→D:______________________________
C→D:______________________________
(4)现将C与NaHCO3固体按物质的量之比为3:2于真空密闭容器中混合加热,则剩余固体成分为_______________。
(5)将a g葡萄糖在足量氧气中完全燃烧,将所得产物全部通入过量C中,固体增重________a g。(填大于,小于,等于)
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
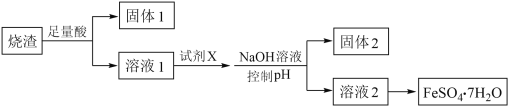
下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为
A. a > b > c > d B. a > c > d > b C. c > a > b .> d D. b > d > c > a
查看答案和解析>>
科目: 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有( )
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 mol Fe2+与足量的H2O2溶液反应,转移NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④常温下,0.4 mol SiO2所含的共价键数目为1.6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
A. 2个 B. 3个 C. 4个 D. 5个
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在“H2A-HA--A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是( )
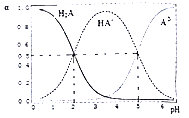
A. Ka1(H2A)=10-2、Ka2(H2A)=10-5
B. pH=6时,c(HA-)∶c(A2-)=1∶10
C. NaHA溶液中,HA-的水解能力小于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol/L的稀盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用________量筒。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面距容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度会______(填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁和玻璃棒或未将洗涤液注入容量瓶,则配制的稀盐酸浓度会________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空。
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是________,只有还原性的是________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是________。
(3)下列三个氧化还原反应中,氧化性最强的物质是________。
①2FeCl3+2KI===2FeCl2+2KCl+I2 ②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还应用上述反应中的________作氧化剂。
(4)请配平以下化学方程式:___
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH===
NaOH===![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:

(1)大小烧杯间填满碎纸条的作用是______;
(2)大烧杯上如不盖硬纸板,求得的中和热数值将___(填“偏大”、“偏小”或“无影响”),结合日常生活的实际该实验在____进行效果更好;
(3)实验中改用60mL0.50molL﹣1盐酸与50mL0.55molL﹣1NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”、“不相等”),简述理由:_____;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____;用50mL 0.5mo1L﹣1NaOH溶液进行上述实验,测得的中和热的数值会____(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com