
科目: 来源: 题型:
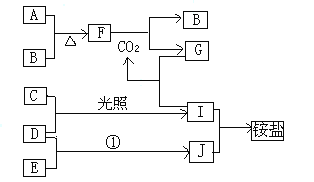
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
请回答下列问题:
(1)写出下列物质化学式:A_______C________D________
(2)写出下列物质间反应的化学方程式:
①A+B____________________;②F+CO2________________
③D+E___________________________;④I+J___________________
(3)写出下列反应的离子方程式G+I________________
查看答案和解析>>
科目: 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。
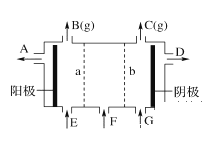
下列说法中正确的是
A. 阴极反应式为4OH--4e-=2H2O+O2↑ B. 从D口出来的是硫酸溶液
C. b是阳离子交换膜,允许Na+通过 D. Na2SO4溶液从E口加入
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到实验目的的是

A. 图甲装罝可证明非金属性强弱:S>C>Si
B. 图乙装置可用于检验有乙烯生成
C. 图丙装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体
D. 图丁装置可用来测定中和热
查看答案和解析>>
科目: 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
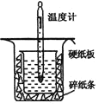
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是______;
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用________。
(3)若改用60mL0.25mol·L-1H2SO4和50mL0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量________(填“相等”、“不相等”)。
(4)50mL0.55mol/L NaOH溶液和50mL0.25mol/L硫酸溶液的实验数据如下表:
请填写下表中的空白:______
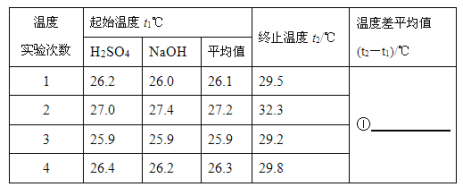
②近似认为50mL0.55mol/LNaOH溶液和50mL0.25 mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=______kJ/mol(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是______。
a.实验装置保温.隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
B. 充电时,当阳极质量增加23.9 g时,溶液中有0.2 mol电子通过
C. 放电时,正极区pH增大
D. 充电时,Pb电极与电源的正极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请写出以下物质的电子式:Na2O2__________H2S___________
(2)用“>”或“<”回答下列问题:
酸性:H2SiO3____H3PO4;稳定性:HCl____CH4;氧化性:Cu2+_____Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)═nZ(g)+6W(g)。2min时生成0.3mol W,此时测知以Z的浓度变化表示的反应速率为0.05molL﹣1min﹣1。
试计算:
(1)前2min内用X的浓度变化表示的平均反应速率为多少?____
(2)计算n值和2min末时Y的浓度(写出必要的计算过程)。______
(3)室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液,则n:m=________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com