
科目: 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是_____(填元素符号),B元素在元素周期表中的位置________。
(2)D与E可形成化合物D2E,该化合物的电子式为________。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜单质反应,该反应的化学方程式为__________。
(4)比较E、F气态氢化物的较稳定的是:________(用分子式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 乙醇的沸点高于丙烷
B. 氨基酸既能与盐酸反应,也能与NaOH反应
C. 甘油、汽油、植物油不属于同一类有机物
D. 光照时异戊烷发生取代反应生成的一氯代物最多有5种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应:![]()
B. 电解饱和食盐水获取烧碱和氯气:![]()
C. 向氢氧化钡溶液中加入稀硫酸:![]()
D. 向碳酸氢铵溶液中加入足量石灰水:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】把19.2 g 的Cu放入体积为1L、浓度为1mol/L的稀硝酸中,微热至Cu完全反应。求:
(1)生成的NO在标准状况下的体积________;
(2)被还原的硝酸的质量_________;
(3)在反应剩余后的溶液中加入足量稀硫酸,则还能溶解铜的最大质量为______
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),△H2
CH3OH(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 molCO和6molH2充入2L的密闭容器中发生反应I,5min后测得c(CO)=0.4 mol/L,计算此段时间的反应速率(用H2表示)___________ mol/(L·min)。
(2)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(3)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某芳香烃A分子式为C8H10,它的主要用途是在石油化学工业作为生产苯乙烯的中间体,所制成的苯乙烯一般被用来制备常用的塑料制品——聚苯乙烯。某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色。J分子内有两个互为对位的取代基。在一定条件下各物质间有如下的转化关系:(无机物略去)

(1)A物质的名称为__________。写出核磁共振氢谱中只有2个特征峰的A的同分异构体的结构简式__________________。
(2)写出X的结构简式______________;J中所含的含氧官能团的名称为_________。
(3)E与H反应的化学方程式是_______________;反应类型是______________。
(4)B、C的混合物在NaOH 乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的结构简式是_________________。
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式________。
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;
③苯环上的一卤代物有2种;④能发生水解反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)向CuSO4溶液中逐滴滴加氨水至过量,过程中会先有沉淀生成,后沉淀逐渐溶解。
①写出沉淀溶解过程的离子方程式___________________。
②Cu2+基态时核外电子排布式为____________________。
③金属铜采取_____堆积。
④NH3分子空间构型为__________________。
(2)制备CrO2Cl2的反应为:K2Cr2O7+3CCl4=2KC1+2CrO2Cl2+3COC12↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为____________________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相似,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm,则熔点:NiO____FeO(填“>”、“<”或“=”)。
(4)Ni和La的合金是目前使用广泛的储氢材料。具有大容量、高寿命、耐低温等特点,在日本和中国己实现了产业化。该合金的晶胞结构如下图所示。
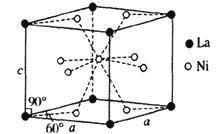
①该晶体的化学式为_______________________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是_________cm3(用含M、d、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】索氏制碱又称氨碱法,其主要生产流程如左下图:
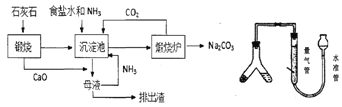
(1)粗盐中常含Ca2+、Mg2+、SO42-等杂质离子,可依次加入NaOH、____、____、盐酸试剂来进行提纯。
(2)用化学方程式表示沉淀池中发生的反应为________________________________。
(3)氨碱法制得的纯碱样品中可能会含有MaCl杂质。现用量气法测定纯碱样品的纯度,(如右上图)如何检查该装置的气密性_________________________________,称取m克样品装入Y型管左侧,量气管中液体应为______________(填字母)。
A.水 B.饱和食盐水 C.饱和碳酸钠溶液 D.饱和碳酸氢钠溶液
(4)若最后测得产生CO2气体的体积为VL(标况下),则样品中纯碱的纯度为_________。若最后读数时,发现水准管液面高于量气管(其他操作都正确),则计算所得纯碱样品的纯度值_____(填“偏大”,“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于食物所含营养素的说法错误的是( )
A.谷类只提供糖类
B.蔬菜是某些维生素、无机盐和膳食纤维的主要来源
C.油脂主要提供脂肪,特别是必需高级脂肪酸
D.鱼、虾、蛋、奶等能提供优质蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com