
科目: 来源: 题型:
【题目】一定温度下在容积恒定的密团容器中发生反应A(s)+2B(g)![]() C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
A. v正(B)=2v逆(C) B. 每消耗1molC,同时生成1molD
C. 气体的密度保持不变 D. B、C、D三种物质的浓度之比为2:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是

A. a点的溶液呈中性
B. 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-= Al(OH)3↓+2BaSO4↓
C. c点加入Ba(OH)2溶液的体积为200 mL
D. c点溶液呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】向某NaOH溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)(3)(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断一定正确的是(不计CO2的溶解)
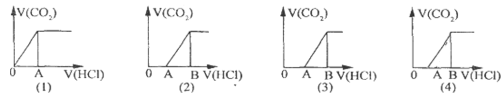
A. (1)图显示M中只有一种溶质且为Na2CO3
B. (3)图显示M中有两种溶质且为Na2CO3、NaOH
C. (2)图显示M中有两种溶质且为Na2CO3、NaHCO3
D. (4)图显示M中c(NaHCO3)=c(Na2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是
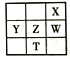
A. X、W、Z的原子半径依次递减
B. Y、Z、W的最高价氧化物的水化物酸性依次递减
C. 根据元索周期表推测T元素的单质具有半导体特性
D. 最低价阴离子的失电子能力X比W强
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述不正确的是
A. 通常状况下,1 mol SO3含有的分子数为NA
B. 1 mol OH-参与电解,转移的电子数目为NA
C. 标准状况下,含NA个氩原子的氩气体积约为22.4 L
D. 标准状况下,V L水含有的氧原子数约为VNA/22.4
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
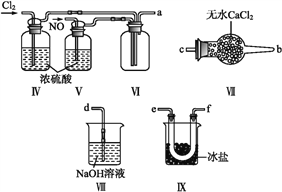
①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.实验室制备POCl3。采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:

资料:①Ag++SCN-=AgSCN↓:Ksp(AgCl)>Ksp(Ag SCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1) 装置B中的作用是观察氧气的流速和______________、_______________ ,干燥管的作用是_____________
(2)反应温度要控制在60~65℃,原因是:________________________________________________
II.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7 g产品(杂质不含氯元素),置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL 溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 moI/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 moI/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
(3)实验室用5.0 moI/L AgNO3 配制100 mL 3.2 moI/L AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还有_____________________
(4)步骤③若不加入硝基苯的将导致测量结果_____(填偏高、偏低或无影响)
(5)步骤④中X可以选择_____。
(6)反应中POCl3的质量百分含量为_____,通过_____(填操作)可以提高产品的纯度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com