
科目: 来源: 题型:
【题目】下列除去杂质的方法错误的是
物质 | 杂质 | 除杂剂 | |
A | 镁粉 | 铝粉 | 过量烧碱溶液 |
B | FeCl3(溶液) | FeCl2 | 氯气 |
C | CO2 | HCl | 饱和Na2CO3溶液 |
D | Cl2 | HCl | 饱和食盐水 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. NaNO2溶液与酸性KMnO4溶液:2MnO4﹣+5NO2﹣+6H+═2Mn2++5NO3﹣+3H2O
B. 碳酸氢铵溶液与足量氢氧化钡溶液:NH4++HCO3﹣+2OH﹣═CO32﹣+NH3H2O+H2O
C. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I﹣═2Fe2++I2
D. 用惰性电极电解氯化钠溶液:2Cl﹣+2H2O═Cl2↑+H2↑+2OH﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】三草酸合铁(III)酸钾K3[Fe(C204)3]·3H2O为绿色晶体,易溶于水,难溶于乙醇丙酮等有机溶剂。
I.三草酸合铁(III)酸钾晶体的制备
①将5g(NH4)2Fe(S04)2·6H2O晶体溶于20mL水中,加入5滴6mol/LH2SO4酸化,加热溶解,搅拌下加入25m饱和和H2C2O4溶液,加热,静置,待黄色的Fe C2O4沉淀完全沉降以后,倾去上层清液,倾析法洗涤沉定2--3次。
②向沉淀中加入10mL饱和草酸钾容液,水浴加热至40℃,用滴管缓慢滴加12mL5%H2O2,边加边搅拌并维持在40℃左右,溶液变成绿色并有棕色的沉淀生成。
③加热煮沸段时间后,再分两批共加入8mL饱和H2C2O4溶液(先加5mL,后慢慢滴加3mL)此时棕色沉淀溶解,变为绿色透明溶液。
④向滤液中缓慢加入10mL95%的乙醇,这时如果滤液浑浊可微热使其变清,放置暗处冷却,结晶完全后,抽滤,用少量洗条剂洗涤晶体两次抽干,干燥,称量,计算产率。
已知制各过程中涉及的主要反应方程式如下:
②6FeC2O4+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3
步骤③2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
请回答下列各题:
(1)简达倾析法的适用范围____________。
(2)步骤③加热煮沸的目的是___________。
(3)步骤④中乙醇要缓慢加入的原因是_________。
(4)下列物质中最适合作为晶体洗涤剂的是_______(填编号)。
A.冷水 B.丙酮 C.95%的乙醇 D.无水乙醇
(5)如图装置,经过一系列操作完成晶体的抽滤和洗涤。请选择合适的编号,按正确的顺序补充完整(洗条操作只需要考虑一次):开抽气泵→a→____→b→d→c→关闭抽气泵。
a.转移固体混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
II.纯度的测定
称取1.000g产品,配制成250mL溶液,移取25.00mL溶液,酸化后用标定浓度为0.0100 mol/L 的高锰酸钾溶被滴定至终点,三次平行实验平均消耗高猛酸钾溶被24.00 mL。
(6)滴定涉及反应的离子方程式:____________。
(7)计算产品的纯度______(用质量百分数表示)。(K3[Fe(C204)3]·3H2O的相对分子质量为491)
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙道常用氢气与纯净的金属钙加热制取,如图是模拟制取装置:
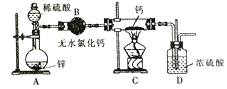
(1)为了确认进入装置C的氢气已经干燥应在B、C之间再接一装置,该装置中加入的试剂是______________。
(2)该实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,接下来的操作顺序是_______(填序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)某同学取一定质量的产物样品(m1g),加入过量碳酸钠溶液,过滤、洗涤、干燥后称量固体碳酸钙质量(m2g),计算得到样品中氢化钙的质量分数为101.14%。若该同学所有操作均正确,则产生这种情况的原因可能是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A. K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应若有67.2 L氯气生成,电子转移数目为5NA
B. 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA
C. 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA
D. 60g乙酸和葡萄糖混合物充分燃烧消耗NA个O2
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系的压强不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥B. ①③④⑥C. ②③④⑥D. ①③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】在一固定容积的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L,0.1 mol/L,0.2 mol/L, 当反应达到平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L,0.1 mol/L,0.2 mol/L, 当反应达到平衡时,可能存在的数据是( )
A. SO2为0.4 mol/L,O2为 0.2 mol/L
B. SO2为0.25 mol/L
C. SO2、SO3均为0.15 mol/L
D. SO3为0.4 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于胶体的叙述,不正确的是
A.胶体一定是混合物
B.制作豆腐的过程利用了胶体的性质
C.胶体与溶液本质特征的区别是能否发生丁达尔效应
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各溶液中的反应,不论反应物量的多少,都只能用同一个离子方程式来表示的是
A.FeBr2与Cl2B.Ba(OH)2与CO2
C.HCl与Na2CO3D.AlCl3与氨水
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:l的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com