
科目: 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期数与主族序数相等。
请回答下列问题:
![]()
(1)W在周期表中的位置是___________________________________,Q、R、T三种元素原子半径由大到小的顺序为________________________________。(用元素符号表示),
(2)QO2的电子式为_______________,R的最高价氧化物的化学式___________。
(3)T单质与NaOH 溶液反应的离子方程式为______________________
(4)T单质与W最高价氧化物的水化物溶液反应的离子方程式为_______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】I:某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。

(1)该小组同学采用了以下操作制备胶体,请将空白处填写完整。
取一个烧杯,加入20 mL蒸馏水,加热至沸腾,然后向烧杯中滴加1~2 mL饱和______溶液,继续煮沸,待溶液呈____后,停止加热。
(2)将制得的胶体放入半透膜制成的袋内,如图1所示,放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察_____(填“有”或“无”)丁达尔效应;再向烧杯中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为______________。
(3)将半透膜内的液体倒入U形管中,如图2所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是____(填“阴”或“阳”)极附近颜色逐渐变深,其原因是_______。
II:回答下列问题:
(1)“铝热反应”中的铝热剂通常是Fe2O3和Al粉的混合物,高温反应时可放出大量的热。请写出该反应的化学方程式_________________________。
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A.SiO2硬度大,可用來制造光导纤维B.HClO 显酸性,可用于杀菌消毒
C.SO2具有氧化性,可用于纸浆漂白D.铁粉具有还原性,可用作食品抗氧化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。已知: ClO2浓度过高或受热易分解,甚至会爆炸。现有下列制备ClO2的方法:
(1)方法一:氧化法
可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是_______________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因__________。
(2)方法二:氯化钠电解法
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的____(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②该法工艺原理示意图如图所示。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2,氯化钠电解槽中发生反应的化学方程式为_____________。

(3)方法三:草酸还原法
在酸性溶液中用草酸(H2C2O4)还原氯酸钠的方法来制备ClO2
①写出制备ClO2的离子方程式:____________________;
②与电解法相比,用草酸还原法制备ClO2的特点是____________________,提高了生产、储存及运输过程的安全性。
(4)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH<2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3 反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。
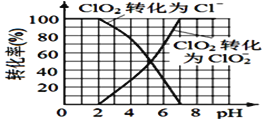
用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:
①用紫外分光光度法测得水样中ClO2的含量为a mol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取V mL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH________。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用c mol/L Na2S2O3 溶液滴定至终点,消耗Na2S2O3 溶液V1 mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为________mol/L( 用含字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、NOx等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1)已知:2C(s)+O2(g)![]() 2CO(g) ΔH1= -221.0 kJ/mol
2CO(g) ΔH1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) ΔH2= +180.5 kJ/mol
2NO (g) ΔH2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
用焦炭还原NO生成无污染气体的热化学方程式为_________________________________。
(2)已知由CO生成CO2的化学方程式为CO+O2![]() CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
(3)CO2可用来生产燃料甲醇。CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=___________________ mol·(L·min) -1。
②氢气的转化率=________________________。
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度 B.充入0.5 mol CO2 和1.5 mol H2
C.充入He(g),使体系压强增大 D.将H2O(g)从体系中分离出去
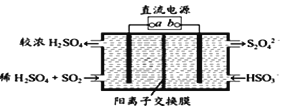
(4)利用如图所示电解装置(电极均为惰性电极)可吸收SO2,并用阴极室排出的溶液吸收NO2 。与电源b极连接的电极的电极反应式为____________________________________。
(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ca(OH)2和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42—(aq)+ Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)。
CaWO4(s)+2OH-(aq)。
(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。

①计算T1时Ksp(CaWO4)=________。
②T1________T2(填“>”、“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表所示:
温度/℃ | 25 | 50 | 90 | 100 |
K | 79.96 | 208.06 | 222.88 | 258.05 |
①该反应平衡常数K的表达式为________________。
②该反应的ΔH________0(填“>”、“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42—的沉淀率为60%,计算实验测得的平衡常数________________。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析作用: __________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出),单质A常作为食品包装材料,甲是两性氧化物。

根据图示转化关系回答:
(1)写出单质A与Fe2O3反应的化学方程式__________________________________
(2)写出电解甲制单质A的化学方程式__________________________________
(3)实验室完成单质A与Fe2O3反应实验,需要的试剂还有_______。
a.KCl b.KClO 3 c.MnO2 d.Mg
(4)利用单质A与Fe2O3反应的原理,工业上可用于___________
查看答案和解析>>
科目: 来源: 题型:
【题目】在澄清透明强酸性溶液中,下列各组离子能大量共存的是
A.K+、Fe2+、NO3-B.Cu2+、SO42-、NO3-C.Fe3+、Cl-、SCN- D.Na+、OH-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com